Qual é a relação entre Epigenética, Plasticidade Fenotípica e Evolução Biológica?
Compartilhe o artigo:
O termo epigenética tipicamente se refere a modificações químicas na cromatina ou em DNA transcrito que podem influenciar na atividade e na expressão genéticas sem mudanças na sequência de DNA (1). Nas últimas duas décadas, vários avanços no campo dos estudos genômicos possibilitaram a exploração desse mecanismo de regulação, o qual acompanha o processo geral de plasticidade fenotípica para englobar informações de expressão fenotípica que estão além do codificado pelos genes no genoma de um organismo. Apesar de já estar bem estabelecido o papel da epigenética e da plasticidade genotípica na emergência de doenças e de fenômenos adaptativos a partir de gatilhos ambientais diversos, ainda estamos no início de começarmos a entender em mais detalhes como os mecanismos não-geneticamente determinados contribuem para o processo evolucionário. Englobando hipóteses próximas de teorias, como o Efeito Baldwin, alguns vêm se referindo a esse campo de estudo evolutivo como Neo-Lamarckianismo.
- (1) Para uma melhor compreensão do tema, fica a sugestão inicial de leitura: Letras artificiais e o maquinário genético.
PLASTICIDADE FENOTÍPICA E EPIGENÉTICA
Tanto a plasticidade fenotípica quanto a epigenética alteram a expressão de um fenótipo ou de um gene sem causar mudanças na sequência de DNA. Definir uma linha que separa ambos os processos é difícil, já que vários marcadores epigenéticos são ambientalmente induzidos, e a plasticidade em si pode ser mediada por modificações epigenéticas, e possíveis efeitos transgeracionais podem ser devidos à plasticidade materna ou à herança epigenética.
EPIGENÉTICA
É ainda muito controverso as tentativas de definição do termo 'epigenética'. Decompondo a palavra, temos que 'epi' significa 'além' e genética significa 'DNA, sequência', ou seja, algo que se refere a uma camada de informação que existe além daquela codificada na sequência de DNA, e, portanto, fazendo o genoma funcionar de forma distinta em diferentes tipos de células ou de ambientes. Essa definição engloba todas as modificações de cromatina e de DNA, e de outros reguladores de transcrição que agem no contexto da cromatina, e que são possíveis de serem transmitidos durante a replicação celular ou mesmo de forma vertical (aos descendentes diretos). De modo generalista e simplista, epigenética seria um mecanismo de 'liga e desliga' dos genes.
Porém, para alguns autores, esse tipo de generalização gera mais desinformações do que coerência, especialmente entre o público (Ref.1). Por exemplo, a metilação do DNA não necessariamente marca um processo epigenético. Mudanças na composição dos subtipos de célula, variabilidade na sequência de DNA e causação reversa (transcrição alterando a metilação do DNA ao invés deste ser alterado pela metilação) podem ser os mecanismos moleculares alternativos. Segundo esses autores, uma proposta de definição mais coerente para epigenética seria a referência a dois tipos de eventos: reprogramação celular e a formação de diferentes proporções de tipos celulares através do uso variável de creodes ('policreodismo') - termo que representa o caminho de desenvolvimento seguido por uma célula à medida que ela cresce para formar parte de um órgão especializado. Em outras palavras, voltaríamos ao significado histórico de epigenética no século XX dado pelo biólogo C.H. Waddington em 1942 no seu artigo "The Epigenotype" para se referir ao processo que baseia a geração de vários tipos celulares a partir de uma única célula zigótica, mesmo com todas as células possuindo a mesma sequência de DNA.
Nesse sentido, informações que estariam contidas além do genoma - e que atuam desligando e ligando genes - seriam descritas como regulações de transcrição, as quais podem agir via epigenética ou outro mecanismo molecular.
Mas, contornando esses debates, podemos pegar emprestado a mais recente definição do GHR (Genetics Home Reference) - pertencente ao NIH (U.S. National Library of Medicine) - de epigenética (Ref.2): "modificações no DNA que não mudam a sequência de DNA mas que podem afetar a atividade genética, ou compostos químicos que são adicionados a genes únicos que podem regular suas atividades". Em outras palavras, o assim chamado epigenoma engloba fatores e processos moleculares ao redor do DNA que regulam a atividade genômica independentemente da sequência de DNA, e que são mitoticamente estáveis (persistem após divisões celulares). Fatores epigenéticos incluem metilação do DNA, modificações de histonas, mudanças na estrutura da cromatina e expressão de RNAs não-codificantes (ncRNA).
Os compostos químicos do epigenoma não fazem parte da sequência (fita) de DNA, mas estão sobre ou anexados ao DNA - apesar de serem produzidos a partir do genoma, assim como as histonas e micro-RNAs (miRNAs). As modificações epigenéticas permanecem à medida que as células se dividem e, em alguns casos, podem ser passadas de geração para geração em organismos mais complexos caso alcancem as células germinativas (diretamente associadas aos gametas reprodutivos; espermatozoide e óvulo, por exemplo), via meiose e mitose - contrariando, portanto, o dogma implicado na genética Mendeliana que permeou o século XX. Influências ambientais, como dieta e exposição a poluentes, podem impactar/engatilhar o epigenoma.
Mudanças epigenéticas podem ajudar a determinar se um ou mais genes são ativados (ligados) ou desativados (desligados), influenciando a produção de proteínas em certas células e garantindo que apenas as proteínas necessárias sejam produzidas. Isso é essencial no processo de diferenciação celular, já que todas as células de um organismo multicelular possuem o mesmo DNA/genótipo. Por exemplo, em células musculares você não terá proteínas de promoção ao crescimento ósseo sendo produzidas, mesmo que os genes necessários para tal estejam ali presentes. Os genes para essa função serão expressos, em condições normais, apenas nas células do tecido ósseo. Padrões de modificações epigenéticas variam entre indivíduos, diferentes tecidos dentro de um indivíduo, e mesmo entre células. Por isso os tecidos e órgãos do corpo são tão diferentes entre si mesmo carregando no núcleo celular, em condições normais, sempre o mesmo genótipo. O epigenoma controla muitas dessas mudanças regulatórias no genoma.
Outro caso notável de interferência epigenética é o processo de imprinting. No genoma humano, por exemplo, temos duas cópias para cada gene, uma oriunda da mãe e outra oriunda do pai. Para um pequeno número de genes, apenas a cópia da mãe é ativada, e a outra, paterna, é silenciada; já em outros genes, a cópia do pai é ativada e a da mãe desativada. Sem o epigenoma controlando isso, o corpo não consegue funcionar direito. Aliás, cerca de 5% do epigenoma humano está sempre regulando a expressão genética em qualquer dada célula do corpo.
Um tipo comum de modificação epigenética é a já mencionada metilação, a qual envolve a anexação de pequenas moléculas chamadas de grupos metilas (-CH3) a segmentos do DNA. Quando grupos metilas são adicionados a um gene particular, o gene é desligado ou silenciado, e nenhuma proteína consegue mais ser produzida daquele gene (expressão do gene cessa).
----------
> Metilação do DNA é o mais importante mecanismo epigenético, protegendo a integridade do genoma de organismos multicelulares complexos, silenciando elementos transponíveis e fornecendo memória às células. Por exemplo, distintos padrões de metilação - extensamente conservados entre os animais há pelo menos 500 milhões de anos (Ref.27) - asseguram que uma célula hepática sempre permaneça uma célula hepática, e que uma célula cardíaca sempre permaneça como uma célula cardíaca, mesmo com todas as células carregando os mesmos genes.
> Em algumas espécies de animais, como o verme Caenorhabditis elegans, metilação do DNA e suas enzimas associadas (ex.: metiltransferases) foram perdidas no curso evolucionário. Organismos mais complexos tendem a exibir maior nível de metilação no DNA (ex.: vertebrados > invertebrados). Mas foi estudando esse verme que cientistas descobriram a existência e o papel regulador das moléculas de miRNA, outro importante componente do epigenoma. Aliás, a descoberta do miRNA rendeu o Nobel 2024 de Medicina (Ref.30).
> Além da metilação (5-metilcitosina, ou 5mC), recentemente pesquisadores revelaram um novo marcador epigenético em vertebrados que ativa genes no início do desenvolvimento embrionário. A modificação de DNA em questão - 5-formilcitosina (5fC), formado via ação enzimática de oxidação sobre o 5mC - representa um mecanismo epigenético de regulação genética antes desconhecido e foi observado atuando durante ativação zigótica em embriões de anuros e de camundongos, um crítico período de desenvolvimento quando vários genes são "ligados". O 5fC é a adição de um radical formila (-CHO) em um grupo citosina. Ref.31
----------
Remodeladores de cromatinas e variantes de histonas também atuam de forma importante no maquinário epigenético. Na remodelação de cromatinas, a posição dos nucleossomos - unidade fundamental da cromatina onde a fita do DNA se enrola e formada por quatro pares de histonas (H2A, H2B, H3 e H4) - é crucial para determinar a expressão genética. Nesse sentido, mudanças nas posições das histonas dentro dos nucleossomos - ou remoção ou adição de histonas nessas estruturas - atuam ativando ou desativando genes. Já no segundo caso, variantes de histonas - estruturas proteicas diferenciadas - são incorporadas na cromatina, alterando a forma dos nucleossomos ou a organização da cromatina, com consequente interferência na expressão genética. Um estudo publicado em 2021 na Nature (Ref.22) revelou que a adição da molécula de serotonina é outro modificador de histonas.
Genes com marcadores epigenéticos podem ser transmitidos verticalmente entre gerações (transgeracional) da mesma forma que genes não marcados (via meiose e mitose). Quando um genoma é passado de pai para filho, o epigenoma no novo material genético formado é geralmente resetado (reprogramado). Nesse processo, um maquinário celular especializado rastreia o DNA e apaga as modificações epigenéticas, fazendo com que o material genético volte às "configurações de fábrica" (células-tronco, embrionárias). Porém, sob certas circunstâncias, alguns desses marcadores podem persistir (escapam do reboot). Aliás, o imprinting é exatamente um tipo de persistência do epigenoma, onde, no caso dos mamíferos, ~1% dos genes naturalmente escapam da reprogramação. No caso de divisões celulares nos tecidos e órgãos de um organismo, que não visam a formação de células germinativas, as modificações epigenéticas são, por regra, preservadas, para manter a especialização das células.
Moléculas de RNA não-codificante (ncRNA) também atuam de forma importante em várias funções regulatórias. Moléculas de ncRNA de cadeias longas (lncRNA) e curtas (sncRNA) podem ser produzidos pelo "entulho" do DNA - sequências não-codificantes que se acumulam no genoma, incluindo várias famílias de elementos genômicos móveis, e que possuem importante papel regulatório. Essas moléculas, quando afetam as células germinativas e culminam em transmissão transgeracional de informação extra-genômica, podem ter origem local (ex.: epidídimos em mamíferos machos) ou sistêmica.
O epigenoma geralmente muda quando as células se tornam especializadas (reorganização das histonas e marcadores no DNA) e também pode mudar ao longo da vida de uma pessoa, acompanhando o processo de envelhecimento. Fatores ambientais e estilo de vida também podem engatilhar mudanças no epigenoma, as quais podem ou não ser prejudiciais e causar doenças. Mudanças benéficas no epigenoma acionadas por fatores diversos - como adversidades ambientais - podem ser selecionadas durante o processo evolutivo.
Erros no processo epigenético, como a modificação do gene errado ou falha ao adicionar uma molécula a um gene, podem levar a atividades ou inatividades anormais dos genes, e causar problemas genéticos. Condições incluindo cânceres, desordens metabólicos, e desordens degenerativas são em muitos casos associadas a falhas epigenéticas. No caso de cânceres, marcadores epigenéticos disfuncionais podem silenciar genes essenciais que controlam a proliferação celular. Para exemplificar de forma mais específica, gêmeos idênticos (monozigóticos) costumam ter riscos diferenciados para doenças autoimunes que afetam a tireoide, devido a diferenças de metilação de locais CpG no genoma, levando à expressão de auto-anticorpos anti-tiroglobulinas (TgAb) (Ref.24).
Por outro lado, a epigenética pode ser usada diretamente a favor da medicina. O medicamento temozolomida, por exemplo, atua matando células cancerosas ao adicionar grupos metilas no DNA.
PLASTICIDADE FENOTÍPICA
Plasticidade fenotípica pode ser definida, de forma geral, como a habilidade de um genótipo produzir mais de um fenótipo quando exposto a diferentes ambientes ou como uma resposta a mudanças nas condições ambientais. Mas o entendimento moderno de plasticidade fenotípica não engloba somente processos plásticos na morfologia de um organismo, mas também aspectos comportamentais e de aprendizado. Essas mudanças ocorrem ao longo da vida de um indivíduo, e podem ser reversíveis ou irreversíveis. Tanto uma mudança de coloração da pele/pelagem em um novo ambiente (camuflagem ou proteção contra radiação UV) e o aumento da musculatura após treinos de hipertrofia - ambos plasticidades adaptativas - quanto o aprendizado de uma nova língua por uma criança exposta a uma nova cultura (plasticidade neuronal) são considerados exemplos de plasticidade fenotípica.
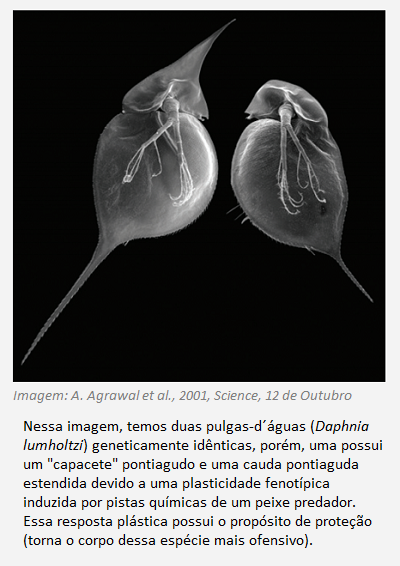
Nesse sentido, dois ou mais indivíduos de uma espécie qualquer, mesmo que possuam o mesmo genótipo (gêmeos monozigóticos ou clones), podem expressar diferentes fenótipos ao serem expostos a diferentes fatores ambientais. Mudanças extremas no fenótipo em diferentes condições ambientais são chamadas de polifenismo, uma forma extrema de plasticidade fenotípica, como o exemplo exposto abaixo.
A plasticidade fenotípica pode emergir a partir de vários mecanismos bioquímicos e nem todos esses mecanismos envolvem epigenética. Para citar um exemplo, a plasticidade fenotípica pode surgir devido a limitações cinéticas associadas a funções enzimáticas. Em uma planta, enzimas envolvidas na fotossíntese possuem faixas ideais de temperatura, com os processos fotossintéticos podendo ficar lentos ou rápidos dependendo da temperatura ambiente. O fator 'temperatura ambiente', portanto, acaba influenciando no crescimento da planta e em outras características fisiológicas, independentemente do genótipo ou epigenótipo. Temos também a hipoxia (baixa concentração de oxigênio gasoso no ambiente), a qual leva à inibição de uma classe de enzimas nos humanos que requerem oxigênio para suas atividades (domínio JmjC-histona demetilase), culminando em uma rápida resposta plástica na cromatina (Ref.23). Outro exemplo é via interferência de RNA (RNAi) (Ref.8), onde sequências longas de RNA de hélice dupla são enzimaticamente quebradas dando origem a siRNAs. O siRNA - associado a um complexo proteico - age clivando RNA mensageiro (mRNA), interferindo nos processos de transcrição e, consequentemente, na expressão de genes.
A plasticidade fenotípica adaptativa é comum na natureza e é superior a soluções não-plásticas para um grande espectro de condições. Muitos organismos estão expostos a ambientes que podem variar drasticamente ao longo das suas vidas. A seleção de alelos que expressam fenótipos mais generalistas e constantes nunca vai garantir a máxima chance de sobrevivência para os espécimes expostos a condições ambientais muito oscilantes, porque ou o fenótipo será razoável em termos adaptativos ao longo de todo o espectro de variação ambiental, ou o fenótipo será ótimo para um ambiente, mas prejudicial/custoso para outro. Com a plasticidade, um fenótipo adaptativo ótimo pode emergir (ser engatilhado) sempre que as condições ambientais variarem, garantindo, de forma contínua, excelente custo-benefício para o organismo.
Citando um exemplo de plasticidade reversível bem conhecido, grande parte dos humanos, ao serem expostos a muita radiação solar (a qual carrega danosos raios UV) respondem com um bronzeamento na pele, aumentando a produção de melanina por um tempo. Esse fenótipo (bronzeamento) ajuda a proteger a pele do UV. Quando a exposição solar excessiva é cessada, a pele gradualmente perde seu bronzeado, porque este diminui a taxa de síntese de vitamina D (2) em um ambiente de baixa exposição solar. Assim, com esse processo de plasticidade fenotípica, a pele sempre mantém um ótimo equilíbrio entre síntese de vitamina D e proteção contra danos do UV.
- (2) Para mais informações: Vitamina D e a cor da pele
Mas nem sempre a plasticidade fenotípica traz benefícios adaptativos, onde mudanças no fenótipo podem ser neutras ou mal adaptativas a nível populacional ou individual. Isso pode ser visto quando limitações nutricionais prejudicam as taxas de reprodução dentro de uma população, mas modificam morfologicamente e/ou metabolicamente seus membros visando um aumento no potencial de sobrevivência individual. Ou seja, o crescimento populacional é prejudicado e os indivíduos podem se encontrar mais vulneráveis frente a ameaças como predadores, já que o corpo mudou de forma específica a uma resposta imediata à escassez de alimentos. Ou existe o caso também em que os custos - gastos energéticos - para manter e/ou ativar as respostas plásticas sejam muito elevados, não compensando os benefícios em muitas situações.
A probabilidade de que uma resposta plástica seja mal adaptativa aumenta quando o ambiente no qual um indivíduo é exposto difere drasticamente daquele no qual seus ancestrais evoluíram. Isso porque genes que foram selecionados no passado para uma melhor adaptação e que foram desativados ao longo do curso evolutivo são aqueles que podem ser ligados novamente devido a mecanismos epigenéticos ou outros ligados à plasticidade. Sem uma carga genética ancestral disponível no genótipo para um determinado fator ambiental adverso, fica mais difícil respostas plásticas emergirem para lidar com o novo problema específico. Nesse sentido, expressões plásticas indesejáveis podem emergir. Por exemplo, quando ervas alpinas Wahlengergia ceracea e Campanula thyrsoides são expostas a temperaturas mais altas típicas de baixas altitudes (~25°C), isso ativa mudanças fenotípicas e fenológicas, mas as quais são acompanhadas por uma substancial redução na capacidade de adaptação.
Nesse sentido, devido à sua base genética, assim como outros complexos fenótipos, a plasticidade pode evoluir em resposta a seleções, caso seja adaptativa.
EPIGENÉTICA, PLASTICIDADE GENOTÍPICA E EVOLUÇÃO
Apesar do epigenoma e das expressões plásticas não alterarem as sequências de DNA/alelos por si só, existem evidências e argumentos teóricos para o envolvimento direto e indireto desses fatores extra-genômicos no curso evolucionário das espécies.
No seu livro "Evolução: A Síntese Moderna", publicado em 1942, o biólogo Inglês Julian Huxley reconciliou a teoria Darwiniana tradicional da evolução com os campos em crescente expansão da genética hereditária Mendeliana e da genética populacional. Centralmente, a Síntese Moderna fornece a base conceitual para racionalizar como seleção natural pode operar sobre variações contínuas emergindo de mutações genéticas aleatórias, incorporando princípios de genética populacional (3). Nesse cenário, exclui-se a possibilidade de que características extra-genômicas adquiridas pelo indivíduo ao longo da vida possam ser passadas adiante ou determinar processos evolutivos - um conceito considerado Lamarckiano e obsoleto.
Sugestão de leitura:
Embora a Síntese Moderna tenha reinado no século XX e início do século XXI, avanços nos campos da genética e da epigenética começaram a apontar que outros processos podem ser tão ou quase tão importantes quanto mutações e fluxos genéticos para os processos evolutivos.
Primeiro, as taxas de mutações genéticas em eucariontes são menores por um fator de 10^5 comparado a taxas de mutações epigenéticas e por ordens de magnitude comparado a taxas fenotípicas. E mutações tendem a trazer prejuízos e raramente benefícios.
Segundo, evidências acumuladas indicam que mutações não ocorrem de forma tão aleatória assim: existem regiões no genoma de organismos diversos mais ou menos suscetíveis a mutações. Certas regiões genômicas são altamente conservadas, mantidas perfeitamente - ou quase perfeitamente - conservadas por dezenas de milhões de anos desde o último ancestral comum.
Terceiro, o persistente conceito conhecido como barreira de Weismann é errôneo e ultrapassado. A alegada separação entre células somáticas e células germinativas (espermatozoides ou óvulos) não existe na prática. Por exemplo, em roedores, o conteúdo de RNA (sncRNA, lncRNA, mcRNA, tsRNA, circRNA, fragmentos de tRNA, etc.) nos espermatozoides muda dependendo de mudanças ambientais que alteram o organismo dos machos, como dieta, fatores de estresse e traumas, e isso acarreta em nova informação herdável e extra-genômica que modifica os fenótipos de potenciais filhotes (Ref.32-33). Essas moléculas de RNA produzidas no corpo [moléculas somáticas] podem ser transportadas para dentro das células germinativas através de vesículas extracelulares (Ref.34).
Quarto, já temos evidência conclusiva de que mudanças epigenéticas podem ser transmitidas ao longo de várias gerações.
Incorporação direta de um fenotípico epigeneticamente herdado no genoma
Existem muitos estudos analisando a possibilidade de que modificações na metilação do DNA possam ser conservadas em uma escala de tempo evolucionária, ou seja, serem fixadas junto ao genoma, alterando permanentemente a expressão de genes ou mesmo mutacionando (paramutação) alelos.
O fenômeno de paramutação - onde interações alélicas diretas criam mudanças passíveis de transmissão vertical no estado de um alelo - podem desse modo influenciar na especiação. Por exemplo, um mecanismo de como isso poderia acontecer pode ser citado em relação às ilhas CpG, as quais são consideradas 'hotspots' mutacionais, já que a citosina metilada pode espontaneamente ser convertida em timina, enquanto guanina metilada é convertida para uracila nessas ilhas. Essas mutações não são consideradas erros pelos mecanismos de reparação do DNA e continuam sendo replicadas durante as divisões celulares e formação de células germinativas. Consequentemente, as mutações se tornam fixadas no genoma e com o potencial de induzir uma mudança na frequência de alelos a nível populacional.
Espermatozoides maduros exibem considerável quantidade de RNA tanto de genes codificantes quanto de genes não-codificantes. RNA não-codificante (ncRNA) encontrado no núcleo de espermatozoides podem impactar o metabolismo e comportamento ao longo de múltiplas gerações.
Efeitos epigenéticos indiretos na evolução: Estabilidade de genes alterada.
Marcadores epigenéticos ambientalmente induzidos podem interferir na estabilidade genética e nas taxas de mutações. Elevados níveis de metilação de citosina aumentam a frequência de mutações como resultado dos elevados níveis de transições citosina-para-timina e outras característica do DNA. Além disso, a metilação do DNA pode interferir tanto com os genes de reparação de danos no DNA quanto com os caminhos apoptóticos que ajudam a manter a integridade genética. Esses efeitos podem contribuir para a mudança de frequência dos alelos a nível populacional, evidenciando processos evolutivos. E esses efeitos agem indiretamente porque não estão necessariamente ligados ao fenótipo associado aos marcadores epigenéticos.
Ao contrário de genes codificantes, o número de genes que expressam lncRNA nos genomas de organismos é relativamente proporcional à complexidade do organismo. Desde plantas até humanos, os tecidos com os maiores números e níveis de lncRNA são os órgãos reprodutivos masculinos. Em moscas Drosophila - e provavelmente em outros animais - células germinativas masculinas exibem altos níveis de lncRNAs, e estes parecem ter crítica influência em processos evolutivos ao controlar a atividade de elementos transponíveis, a expressão do cromossomo Y e a construção do espermatozoide (Ref.36). Os genes de lncRNAs agem minimizando a atividade de transpósons potencialmente prejudiciais, mantendo-os a um nível que promove a evolução de novos genes ao invés de mutações em genes existentes.
----------
> Longas moléculas de RNA não-codificante (lncRNAs) são sequências de RNA com comprimento maior do que 200 nucleotídeos. Em animais, os genes que expressam lncRNA representam uma grande porção do genoma. Em mamíferos, o número de genes que expressam essas moléculas excede em uma ordem de magnitude os genes codificantes.
-----------
Interferência de ncRNAs no desenvolvimento embrionário
RNAs regulatórios, transcritos em tecidos somáticos de um animal em resposta a estímulos estressantes, são empacotados em vesículas extracelulares e liberados na corrente sanguínea. Essas vesículas com a carga de RNA (miRNAs, lncRNAs, etc.) alcançam eventualmente os espermatozoides e esses gametas, então, entregam a carga para o oócito no processo de fertilização. Durante a fusão de material genético dos gametas masculino e feminino e divisões celulares no processo embrionário, as moléculas de RNA podem alterar a organização da cromatina e causar a reprogramação da expressão do perfil genético, resultando na emergência de novidade fenotípica. Eventualmente, a emergência de novas funções e variantes fenotípicas podem originar variações evolucionárias.
Se os doadores de espermatozoides [machos] estão continuamente expostos ao mesmo tipo de estímulo estressante ao longo de gerações, a carga de RNA nesses gametas é esperada de aumentar, concomitantemente aumentando a probabilidade de gerar novidade macroevolucionária estável.
Efeitos epigenéticos e plásticos indiretos na evolução: Seleção natural alterada.
Aqui temos a criação de fenótipos que levam a diferentes seleções naturais de genótipos. Como isso leva a mudanças permanentes na frequência de alelos na população, temos uma interferência no processo evolucionário. Um clássico exemplo disso é o Efeito Baldwin, onde novas características emergindo em um animal via plasticidade fenotípica aumenta suas chances de sobrevivência, podendo servir de ponte para a acomodação de novos genes benéficos. Aliás, o Efeito Baldwin ganhou recentemente uma descrição molecular de suporte via estudo do lagarto-comum (Uta stansburiana) (3).
- (3) Para mais informações: Hipótese evolucionária de 100 anos atrás é ilustrada em detalhes a nível genético
Cinco condições para essa interferência indireta na seleção natural precisam ser atendidas, e todas elas já foram observadas em termos de epigenética:
I. Fenótipos podem ser epigeneticamente e verticalmente transmitidos.
II. Fenótipos epigeneticamente herdados podem ser neutros, adaptativos ou mal-adaptativos
III. Variação no genótipo existe entre membros de uma população.
IV. Variação em marcadores epigenéticos existem entre membros de uma população.
V. Dentro de uma população, um particular conjunto de marcadores epigenéticos podem estar distribuídos completamente e independentemente de um genótipo particular.
Entre as condições a nível populacional acima listadas, todas possuem amplo e sólido suporte científico. Naturalmente, todas as populações de espécies diversas possuem diferenças genéticas entre seus membros. Entre os humanos, por exemplo, existem cerca de 2 a 3 milhões de SNP (polimorfismo único de nucleotídeo) diferentes quando duas pessoas aleatórias dentro de uma população são comparadas, ou seja, milhões de de letras trocadas dentro dos genes e, consequentemente, alelos diferentes.
Da mesma forma, já é bem estabelecido que entre indivíduos de uma mesma população - ou mesmo em um mesmo indivíduo entre idades distintas, ou entre indivíduos com mesmo genótipo - existe uma substancial variação dos marcadores epigenéticos que englobam metilação ou pós-translacional acetilação do DNA, fosforilação de histonas associadas com os núcleos dos nucleossomos, entre outros. Em outras palavras, o epigenoma e o genoma de uma população estão associados com uma significativa heterogeneidade, em maior ou menor extensão.
Sobre a transmissão vertical de fenótipos expressos plasticamente, temos vários exemplos que podem ser citados:
- um estudo publicado em 2018 na Current Biology (Ref.10), mostrou que quando uma população do verme Caenorhabditis
é submetida a temperaturas de 25°C (altas para a espécie), seus
indivíduos se tornam cada vez mais inférteis ao longo das gerações, mas
com esse fenótipo podendo ser revertido a qualquer momento quando as
temperaturas voltavam a ser adequadas (15°C no caso) - ou seja, uma
plasticidade fenotípica que estava emergindo em parte dos indivíduos e
sendo passada de geração para geração. Investigando o fenômeno, os
pesquisadores mostraram que marcadores epigenéticos transgeracionais
estavam afetando o gene set-24.
- um estudo de 2019 (Ref.9) mostrou que esse tipo de transmissão ocorre em ratos, onde filhotes herdam comportamentos aprendidos (plasticidade neuronal aumentada) dos pais, os quais são provavelmente adquiridos via modificações epigenéticas.
- Em experimentos naturais com peixes da espécie Poecilia mexicana, transmissão estável de marcadores de metilação - respondendo a mudanças no ambiente - é demonstrada em até duas gerações. No caso, populações selvagens de P. mexicana habitando ambientes aquáticos com altos níveis de sulfeto de hidrogênio (substância tóxica mesmo em baixos níveis) exibem padrões de metilação distintos em relação a populações selvagens habitando águas com ausência desse estressor ambiental. Mesmo quando peixes adaptados à água tóxica são colocados em ambiente de água não-tóxica, gerações subsequentes conservam grande parte das regiões metiladas no DNA não exibidas nos peixes de água não-tóxica. Ref.28
Assim, a plasticidade fenotípica, especialmente via epigenética, pode alterar as chances de sobrevivência dos indivíduos dentro de uma população, de forma independente do genótipo, e levar a uma variação de alelos entre gerações. No esquema abaixo, isso é melhor exemplificado.
Em particular, quando a plasticidade fenotípica produz traços adaptativos em um novo ambiente, os indivíduos podem experienciar um aumento na probabilidade de persistência. E isso pode levar a uma subsequente "lapidação" desse novo fenótipo adaptativo de forma a otimizar a adaptação local até que aquele fenótipo seja fixado através de um novo genótipo. Esse processo é conhecido como acomodação genética - englobando, por exemplo, o Efeito Baldwin - e faz parte da hipótese PFE (Plasticity-First Evolution), onde a plasticidade fenotípica evolui primeiro para facilitar uma evolução genotípica, a qual virá para fixar o fenótipo adaptativo. Na PEE, a plasticidade fenotípica é expressa na linhagem ancestral e subsequentemente é refinada via seleção natural em um novo fenótipo adaptativo em uma linhagem derivada.
A plasticidade fenotípica, portanto, pode servir como uma ponte para populações se adaptarem a mudanças ambientais. Nesse cenário, a seleção primeiro age em variações genéticas para a plasticidade, favorecendo indivíduos que são capazes de alterar seus fenótipos de formas que melhor 'combinam' com o novo ambiente. Se o antigo ambiente é completamente perdido, seleção irá subsequentemente favorecer a fixação do novo fenótipo plasticamente induzido, devido aos custos associados com a manutenção do maquinário metabólico/estrutural para a resposta plástica ao ambiente. Uma mutação benéfica que expresse esse fenótipo pode eventualmente surgir, levar à eliminação da plasticidade, e ser selecionada e fixada (assimilação genética).
Nós últimos anos, vários exemplos teóricos e práticos de acomodação genética vem emergindo para explicar padrões de especiação e de variação fenotípica entre as populações de uma espécie. Como já citado, o Efeito Baldwin é o mais conhecido e já exaustivamente ilustrado em populações de lagartos do gênero Uta.
HUMANOS, ALTITUDE E HIPOXIA
Um exemplo bem notável de provável acomodação genética pode ser vista em populações humanas que vivem em altas altitudes e sob ambientes de hipoxia. Os humanos que vivem em baixas altitudes, onde a concentração de oxigênio é alta, exibem uma tolerância à hipoxia (baixa concentração de oxigênio) quando movidos para altas altitudes (ar mais rarefeito) na forma de plasticidade fenotípica: aumento da taxa respiratória (hiperventilação com concomitante alcalose) e da taxa cardíaca (entrega mais rápida de oxigênio aos diferentes tecidos do corpo), seguido por supressão de outras funções (digestão, por exemplo, para diminuir o gasto energético) e diminuição do volume de plasma (para aumentar a concentração de hemoglobina circulante). Subsequente aclimatização (longo período de adaptação) resulta em um aumento da produção de eritrócitos, capilares, mitocôndrias e enzimas aeróbicas, e na redução do volume de batidas cardíacas. Essas respostas à hipoxia são medidas pelo fator HIF, o qual gera uma sinalização em cascata que afeta a expressão de genes envolvidos na produção de eritrócitos, glicólise, homeostase do pH, metabolismo lipídico, e a formação de novos vasos sanguíneos.
Populações humanas adaptadas a altas altitudes possuem características genéticas que estão relacionadas às respostas plásticas adaptativas de populações nas baixas altitudes. Os Tibetanos inalam mais ar a cada respiração, respiram mais rápido e possuem um maior fluxo de sangue no cérebro, mas possuem significativamente menor saturação de oxigênio. Já os Andinos possuem níveis de saturação de oxigênio e taxas de respiração similares àquelas de populações em baixas altitudes, mas possuem uma capacidade maior para carregar oxigênio e células vermelhas no sangue. Etíopes Amhara possuem pequena redução na saturação de oxigênio ou maiores níveis de hemoglobina, enquanto os Etíopes Oromo possuem saturação de oxigênio reduzida e um aumento nos níveis de hemoglobina. Esses diferentes padrões de adaptações fixadas via variações genéticas sugerem uma evolução convergente para a tolerância à hipoxia.
Essas populações em altas altitudes possuem características genéticas que apontam seleção natural em alguns loci (locais fixos onde genes ou marcadores genéticos estão posicionados). Dois caminhos de loci do fator HIF - EGLN1 (caminho HIF-1) E epas1 (HIF-2-alfa) - estão associados com níveis reduzidos de hemoglobina, apesar dos alelos diferirem entre populações. Variantes do EGLN1, as quais degradam o fator HIF sob condições normais, estão sob seleção positiva tanto nos Tibetanos quanto nos Andinos, onde nos Tibetanos o EPAS1 está sob elevada seleção. Outros prováveis genes no caminho HIF podem ser citados: PPARA, um fator de transcrição regulando o metabolismo de lipídios, está sob seleção nos Tibetanos; e os THRB e ARNT2 estão sob seleção na Etiópia, assim como o BHLHE41, um repressor de transcrição hipoxia-induzido.
Essas mudanças evolutivas em genes do caminho HIF ancestral (em comum com as populações de baixa altitude) sugerem fortemente acomodação genética via mutações genéticas associadas a reguladores de respostas plásticas à hipoxia (como os genes EGLN1 e HIF1AN). De forma similar, uma perda de função do EPAS1, envolvido no aumento de produção de eritrócitos relacionados à hipoxia, pode reduzir a resposta plástica a baixos níveis de oxigênio e produzir as características baixas concentrações de hemoglobina dos Tibetanos.
Os caranguejos-reis (família Lithodidae) são crustáceos com ausência de concha e que apresentam simetria bilateral, mas que evoluíram de ancestrais que carregavam conchas (conchas vazias de gastrópodes encontradas no fundo do mar) e que eram altamente assimétricos. Em um clado irmão com assimetria inata, uma espécie de caranguejo ermitão (Clibanarius vittatus) se torna simétrico após sucessivas trocas de exoesqueleto se conchas de gastrópodes não são fornecidas. Isso sugere que a perda da concha em um ancestral dos caranguejos-reis envolveu uma plasticidade fenotípica inicial expressando simetria bilateral que foi subsequentemente e geneticamente assimilada para um padrão fixo de desenvolvimento.
GIRINOS CARNÍVOROS
Algumas espécies de sapo da família Scaphiopodidae, como a Scaphioppus holbrookii, nunca naturalmente desenvolvem girinos carnívoros, assim como a maioria dos sapos. Já outra espécie, a Spea multiplicata, produz uma mistura de girinos carnívoros ou onívoros dependendo da disponibilidade de alimentos - ou seja, uma clara plasticidade fenotípica - o que permite uma maior exploração de nichos ecológicos e uma maior chance de sobrevivência. Porém, girinos da espécie Spea bombifrons que compartilham o mesmo habitat com os girinos da S. multiplicata são quase todos carnívoros.
Nesse sentido, um estudo publicado em 2018 na Nature & Ecology (Ref.13) investigou a capacidade de plasticidade dessas três espécies em relação a diferentes dietas. Variando a proporção de camarões oferecidos junto com alimentos de origem vegetal - dieta mais ou menos carnívora - os pesquisadores observaram pouca plasticidade no S. holbrookii mesmo em uma dieta 100% carnívora, onde notou-se o surgimento de um intestino ligeiramente mais curto (mais adaptado para uma dieta carnívora) e sutis alterações em partes bucais. Na espécie S. multiplicata, em contraste, foi observado uma forte plasticidade fenotípica, tanto no formato da cabeça, no intestino e no comportamento. Quando uma dieta carnívora era oferecida, genes ligados ao metabolismo de proteínas se tornaram mais ativos, em detrimento de atividade em genes ligados ao processamento de gorduras e amido. E se dada uma dieta com pouco ou nenhum camarão (herbívora), todas essas adaptações eram revertidas.
Já o mais notável foi observado na espécie Sp. bombifrons, a qual, independentemente da dieta oferecida, continuou carnívora, não demonstrando significativa plasticidade fenotípica. E mais: alguns girinos saíram dos ovos já carnívoros, significando a fixação desse fenótipo, provavelmente via mutações genéticas adaptativas. Quando a dieta oferecida era estritamente herbívora, os girinos dessa espécie mostraram grande dificuldade para reganhar traços fenotípicos apropriados para uma dieta onívora. Girinos carnívoros se desenvolvem mais rapidamente em ambientes simpátricos, e isso possibilita a exploração de outros nichos, como poças de água efêmeras (que secam rápido). Essa é uma forte evidência de que populações de sapo da família Scaphiopodidae estão evoluindo via acomodação genética, especificamente via assimilação genética.
Nessa mesma linha, um estudo publicado em 2019 na Proceedings of the Royal Society B: Biological Sciences (Ref.14), testando a validade da hipótese da PPF, estudou dois tipos de populações naturais de girinos da espécie S. bombifrons: aquelas convivendo no mesmo ambiente que os girinos da espécie Sp. multiplicata (simpátricas) e aquelas isoladas (alopátricas). As populações simpátricas são justamente aquelas onde o fenótipo carnívoro é o mais frequente, com os indivíduos se alimentando de pequenas crustáceos ou de outros girinos. Já nas populações alopátricas é onde o fenótipo onívoro é o mais frequente. As populações das duas espécies só entraram em contato posteriormente - com a expansão territorial da S. bombifrons -, e, portanto, as populações simpátricas representam o estado 'derivado' e as populações alopátricas representam o estado 'ancestral'.
Variando a dieta para essas populações em experimentos laboratoriais, os pesquisadores mostraram que os indivíduos de origem simpátrica expressavam com mais frequência o fenótipo carnívoro do que os indivíduos de origem alopátrica quando nas mesmas condições, e cresciam mais sob uma alimentação carnívora (e as populações onívoras se davam melhor quando a dieta era pouco carnívora). Ambas as observações apontam um refinamento adaptativo da plasticidade nas populações simpátricas. Além disso, os girinos de origem simpátrica desenvolviam uma musculatura maxilar maior, presumivelmente adaptada para uma dieta carnívora. Isso corrobora o estudo de 2018, mostrando que de uma população ancestral um novo genótipo parece ter evoluído através da fixação do fenótipo plástico via assimilação genética, aumentando as chances de sobrevivência dos girinos S. bombifrons simpátricos.
Ainda explorando esses sapos, temos mais um provável caso de acomodação genética apontado por um estudo também publicado na Ecology & Evolution (Ref.15). Em vários anfíbios anuros, a aceleração da metamorfose ocorre em resposta ao secamento de poças de água, com tal processo de plasticidade fenotípica amplamente dependente do aumento na produção e ação de hormônios da tireoide (TH e CORT). Isso é especialmente verdade para os sapos da família Scaphiopodidae, os quais ocupam um variado espectro de habitas, do árido e semi-árido até florestas temperadas.
Nesse sentido, os pesquisadores resolveram estudar três espécies de sapos: a já explorada S. multiplicata, a Scaphiopus couchii, e a Pelobates cultiripes, essa última pertencente à família Pelobatidae. A Sc. couchii deposita ovos nos mais efêmeros reservatórios de água e cujo período larval é o mais curto de todos os anuros conhecidos. A P. cultripes deposita ovos em reservatórios de longa duração e possui o mais longo período larval das três espécies estudadas. A S. multiplicata é intermediária em ambos os aspectos.
Tanto a S. multiplicata quanto a P. cultripes possuem plasticidade fenotípica ativada quando os ovos são colocados em reservatórios de água efêmeros, onde os níveis de hormônios da tireoide são aumentados e a metamorfose é acelerada. Porém, os pesquisadores mostraram que a Sc. couchii não possui uma significativa plasticidade independentemente do nível de água onde seus ovos eram colocados, já apresentando diversas características fixadas que conversam com sua acelerada metamorfose quando comparado com as outras duas espécies: membros traseiros mais curtos, formato alterado da cabeça, tempo alterado para a diferenciação das gônadas, e menor acúmulo de gordura na região abdominal. Todas essas características são vistas nas duas outras espécies quando estas passam pela transformação plástica.
Os pesquisadores então testaram a hipótese de que o Sc. couchii passou por um processo evolutivo de acomodação genética via alteração mutagênica na regulação endócrina, aproveitando da plasticidade fenotípica compartilhada entre as famílias Pelobatidae e Scaphiopodidae. Monitorando populações das três espécies em ambiente laboratorial, eles mostraram que as sinalizações endócrinas de plasticidade e aquelas vistas fixadas na Sc. couchii eram similares, dando forte suporte à hipótese.
NEMATELMINTO E SACRIFÍCIO MATERNO
O pesquisador Christian Braendle, do Instituto de Biologia da Universidade de Nice, França, detalhou a nível molecular como a plasticidade fenotípica do famoso verme Caenorhabditis elegans intermediou um processo evolutivo através de uma única mutação. O C. elegans, quando em um ambiente rico em alimentos - geralmente parasitando microrganismos em frutas em processo de apodrecimento - deposita ovos via vulva no ambiente, onde os filhotes saem para se alimentarem junto aos adultos. Porém, quando existe extrema escassez de alimentos no ambiente, os adultos não mais depositam os ovos gerados internamente, deixando os filhotes eclodirem dos ovos de dentro dos seus corpos e se alimentarem do progenitor. Ou seja, a mãe se sacrifica para fornecer alimento. Essa mudança fisiológica é alcançada via efeitos plásticos, os quais são revertidos assim que os alimentos voltam a ficar abundantes no ambiente. Esse efeito plástico age via alteração no caminho de sinalização de genes - como o lin-3(rf) - que afetam a indução vulval (Ref.17).
No entanto, os pesquisadores encontraram que algumas populações de C. elegans tinham perdido essa plasticidade fenotípica e passaram a gerar os filhotes internamente a partir dos ovos impedidos de saírem pela vulva, independentemente da disponibilidade de alimentos no ambiente. E como esse processo não representou um evento isolado, provavelmente marcou a aquisição de um traço adaptativo, permitindo que mais filhotes sobrevivessem. Ou seja, esse fenotípico certamente se fixou via assimilação genética.
Analisando as bases genéticas do fenômeno (Ref.18), os pesquisadores encontraram que um gene crucial no funcionamento da vulva foi modificado (mutação) - uma única base -, alterando os canais de íon na membrana plasmática. Como resultado, os músculos da vulva falham em responder às sinalizações moleculares que normalmente induziriam a expulsão dos ovos, fazendo com que estes eclodam internamente.
PLASTICIDADE E ESPECIAÇÃO
A plasticidade fenotípica pode também atuar diretamente na especiação, além da acomodação genética, ao facilitar o isolamento reprodutivo de indivíduos de uma mesma população, ou entre populações de diferentes subespécies que estão em contato direto (especiação simpátrica). Em populações simpátricas de uma mesma espécie - ou de espécies diferentes mas geneticamente muito próximas -, o alto fluxo de genes muitas vezes dificulta o processo de especiação. Mas expressão de um fenótipo comportamental de acasalamento diferenciado pode dificultar o fluxo genético entre diferentes grupos de indivíduos muito próximo relacionados, facilitando a emergência de diferentes caminhos evolucionários.
Para exemplificar, um grupo de peixes geneticamente muito próximos que vivem na região do Caribe - popularmente chamados de Hamlet e pertencentes ao gênero Hypoplectrus - basicamente se diferenciam entre si apenas pelo padrão de cores. Mesmo assim, as diferentes espécies dentro desse grupo são mantidos reprodutivamente isoladas, porque para o acasalamento entre machos e fêmeas o reconhecimento é baseado fortemente em pistas visuais. Nesse sentido, uma assimilação genética pode oferecer novos fenótipos que, mesmo sutis, são suficientes para levar indivíduos de uma população ao isolamento reprodutivo em relação a outras populações da mesma espécie, facilitando a especiação.
- Continua após o anúncio -
CONCLUSÃO
Por não atuarem alterando as sequências de DNA, os mecanismos epigenéticos e plásticos foram por muito tempo ignorados como potenciais fatores promovendo os processos evolutivos.
Aliás, muitos acadêmicos acreditavam que a plasticidade fenotípica era um fator agindo de forma antagônica aos mecanismos evolutivos, já que os organismos se tornariam mais flexíveis às mudanças das condições ambientais expressando diferentes fenótipos sem necessariamente ocorrer mudanças nas frequências de alelo. Porém, as evidências se acumulando nas últimas décadas mostram que isso passa longe da verdade, e boa parte da comunidade científica já pede um status teórico ao mecanismo de acomodação genética.
Jean-Baptiste Lamarck (1744-1829) - um importante cientista no campo biológico - é amplamente reconhecido por sua proposta de que os organismos se modificavam ao adquirir traços adaptativos a partir do uso e desuso de características em resposta às variações das condições ambientais. Seguindo esse raciocínio, girafas possuem longos pescoços porque estavam tentando alcançar folhas comestíveis em galhos mais altos. Tal ideia foi eventualmente descartada para dar lugar às mutações aleatórias e subsequente seleção de variações genéticas adaptativas como o grande pilar de suporte para as modificações à nível populacional que os organismos experienciavam (4). Agora, com a emergência da epigenética e plasticidade fenotípica, Lamarck pode voltar a dormir sossegado em seu túmulo porque sua proposta não parece estar de todo errada.
- (4) Só lembrando que existem outros mecanismos de evolução biológica além das mutações e da seleção natural, como a deriva genética. Todo processo que leva a variações na frequência de alelos em uma população ao longo de gerações é um processo evolutivo. Leitura recomendada: Evolução Biológica é um FATO CIENTÍFICO
REFERÊNCIAS CIENTÍFICAS
- https://www.nature.com/articles/nrm.2017.135
- http://www.genetics.org/content/211/2/549
- https://ghr.nlm.nih.gov/primer/howgeneswork/epigenome
- https://www.nature.com/articles/s41437-018-0114-x
- https://www.novusbio.com/research-areas/epigenetics/epigenetic-machinery
- https://www.nature.com/articles/nature14248
- https://academic.oup.com/icb/article-abstract/58/6/1098/5112966
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5542916/
- http://www.eneuro.org/content/6/1/ENEURO.0252-18.2018
- https://www.sciencedirect.com/science/article/pii/S0960982218307619
- https://www.ncbi.nlm.nih.gov/pubmed/24719220
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4929538/
- https://www.nature.com/articles/s41559-018-0601-8
- https://doi.org/10.1098/rspb.2018.2754
- https://www.nature.com/articles/s41467-017-00996-5
- http://www.g3journal.org/content/8/9/3069.abstract
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6118308/
- https://www.sciencemag.org/news/2018/11/cannibalistic-tadpoles-and-matricidal-worms-point-powerful-new-helper-evolution
- https://www.ncbi.nlm.nih.gov/pubmed/29786096
- https://journals.plos.org/ploscompbiol/article?id=10.1371/journal.pcbi.1006260
- https://www.ncbi.nlm.nih.gov/pubmed/24410266
- https://www.nature.com/articles/d41586-019-00532-z
- http://science.sciencemag.org/content/363/6432/1222
- https://www.liebertpub.com/doi/10.1089/thy.2017.0273
- https://academic.oup.com/gbe/advance-article/doi/10.1093/gbe/evaa239/5981114
- Sarkies, P. (2023). Evolution beyond DNA: epigenetic drivers for evolutionary change?. BMC Biology 21, 272. https://doi.org/10.1186/s12915-023-01770-4
- Klughammer et al. (2023). Comparative analysis of genome-scale, base-resolution DNA methylation profiles across 580 animal species. Nature Communications 14, 232. https://doi.org/10.1038/s41467-022-34828-y
- Kelley et al. (2021). Epigenetic inheritance of DNA methylation changes in fish living in hydrogen sulfide–rich springs. PNAS, 118 (26) e2014929118.
https://doi.org/10.1073/pnas.2014929118 - Kato et al. (2024). Identification of gene isoforms and their switching events between male and female embryos of the parthenogenetic crustacean Daphnia magna. Scientific Reports 14, 9407. https://doi.org/10.1038/s41598-024-59774-1
- https://www.nobelprize.org/prizes/medicine/2024/press-release/
- Niehrs et al. (2024). 5-Formylcytosine is an activating epigenetic mark for RNA Pol III during zygotic reprogramming. Cell. https://doi.org/10.1016/j.cell.2024.08.011
- Bline et al. (2020). "What Is Lost in the Weismann Barrier?" Journal of Developmental Biology, 8(4): 35. https://doi.org/10.3390%2Fjdb8040035
- Nilsson et al. (2020). Environmentally Induced Epigenetic Transgenerational Inheritance and the Weismann Barrier: The Dawn of Neo-Lamarckian Theory. Journal of Developmental Biology, 8(4): 28. https://doi.org/10.3390%2Fjdb8040028
- Spadafora, C. (2023). The epigenetic basis of evolution. Progress in Biophysics and Molecular Biology, Volume 178, Pages 57-69. https://doi.org/10.1016/j.pbiomolbio.2023.01.005
- Gowri & Monteiro (2024). Haemolymph transfusions transfer heritable learned novel odour preferences to naive larvae of Bicyclus anynana butterflies. Biology Letters, Volume 20, Issue 5. https://doi.org/10.1098/rsbl.2023.0595
- Shao et al. (2024). Spatially revealed roles for lncRNAs in Drosophila spermatogenesis, Y chromosome function and evolution. Nature Communications 15, 3806. https://doi.org/10.1038/s41467-024-47346-w