Qual é a causa mais comum da Síndrome de Guillain-Barré?
 |
| Figura 1. Imagem por microscopia de escaneamento eletrônico (SEM) de bactérias Gram-negativas da espécie Campylobacter jejuni (ampliação de 11734x). Ref.1 |
Um adolescente de 15 anos de idade foi internado no Departamento Pediátrico de um Hospital em Częstochowa, Polônia. Entrevista médica revelou que o menino teve uma infecção gastrointestinal prévia, tratada sintomaticamente com bons resultados. Cerca de duas semanas após o desaparecimento dos sintomas gastrointestinais, dor e fraqueza muscular nos membros emergiram, especialmente nos membros inferiores.
Exame do líquido cefalorraquidiano (no terceiro dia após o aparecimento de distúrbio locomotor) revelou um aumento moderado nos níveis de proteína (52 mg/dl) e citose (18 células/3 ml). Estudos eletrofisiológicos (condutividade, eletromiografia) nos nervos periféricos dos membros superiores e inferiores mostraram danos nas fibras motoras (axonal-desmielinizante), com bloqueio de condução e predominância significativa nos membros inferiores.
O tratamento inicial incluiu metilprednisolona e um conjunto de vitaminas, resultando em uma ligeira melhora na função locomotora. Durante a internação do paciente, manteve-se corticoterapia intravenosa. Imagem por ressonância magnética da seção lombossacral da medula espinhal não apontou anormalidades. Estudos eletrofisiológicos foram realizados na terceira semana após o início dos sintomas da doença, apontando melhora nas funções condutoras dos nervos. Na terceira semana desde o início da doença, o paciente recebeu alta; exame neurológico não revelou danos no sistema nervoso central e o paciente estava exibindo funções locomotoras normais.
Exames laboratorial das fezes do paciente identificaram a bactéria patológica Campylobacter jejuni, uma causa comum de infecções gastrointestinais com diarreia. Teste específico de PCR também confirmou a espécie bacteriana.
Com base nas evidências clínicas e laboratoriais, o paciente foi diagnosticado com síndrome de Guillain-Barré engatilhada pela infecção com a bactéria C. jejuni. O relato de caso foi publicado em 2008 no periódico Medycyna Doswiadczalna i Mikrobiologia (Ref.2).
SÍNDROME DE GUILLAIN-BARRÉ
A Síndrome de Guillain-Barré (SGB) é uma desordem autoimune do sistema nervoso periférico caracterizada por fraqueza motora ascendente simétrica aguda ou subaguda, disreflexia, e anormalidades sensoriais leves a moderadas. Após as campanhas de erradicação de poliomielite, essa síndrome se tornou a causa mais comum de paralisia flácida aguda e com uma incidência anual aproximada de 0,6-4 casos a cada 100 mil pessoas ao redor do mundo (Ref.3). Prevalência no sexo masculino parece ser ~1,5 vezes maior do que no sexo feminino (Ref.4). Entre sintomas específicos da síndrome, podemos destacar a paralisia flácida aguda simétrica, onde é observada redução gradual, simétrica e ascendente da força muscular, podendo evoluir para hipotonia/atonia, hiporreflexia/arreflexia.
Diferentes subtipos de SGB são definidos de acordo com a apresentação clínica e achados de estudos sobre a condução de nervos (lesões motoras, sensoriais, axonais, desmielinizantes). O mais comum desses subtipos, particularmente no hemisfério ocidental, é a polineuropatia inflamatória desmielinizante aguda (AIDP, na sigla em inglês) (Fig.2). A apresentação clínica da SGB é diversa, dependendo do subtipo em questão. Na maioria dos casos, a síndrome apresenta-se com progressiva fraqueza muscular ascendente dos membros com ou sem envolvimento de fibras sensoriais ou autonômicas. Ocasionalmente, músculos faciais são também afetadas. Reflexos dos tendões são geralmente reduzidos, mas hiperreflexia tem sido ocasionalmente reportada. A principal preocupação da SGB é a insuficiência respiratória aguda, quadro que ocorre em virtude do acometimento da musculatura respiratória acessória. SGB severa com rápida deterioração é chamada de 'SGB fulminante' (Ref.5).
Características patológicas da síndrome são hiperemia e edema da raiz nervosa, gânglio e dos nervos periféricos. Infiltração celular inflamatória perivascular local e mudanças de desmielinização nervosa podem resultar em degeneração axonal. A síndrome é acusada por múltiplas lesões na raiz dos nervos e nos nervos periféricos.
Aproximadamente 60% dos pacientes com SGB apresentam um episódio prévio de infecção gastrointestinal ou infecção respiratória, causada por uma bactéria (ex.: Campylobacter sp.) ou um vírus (ex.: bronquiolite causada pelo vírus sincicial respiratório), semanas antes da manifestação dos sintomas nervosos da síndrome - e, por esse motivo, a doença é também conhecida como polineuropatia pós-infecciosa (Ref.7) (1). Porém, alguns raros casos de SGB podem ser engatilhados por outros agentes não-infecciosos, como cirurgias e infarto miocárdico (Ref.3-4, 8). Infecções prévias engatilham a produção de autoanticorpos de reatividade cruzada contra gangliosídeos concentrados em nervos periféricos humanos, deflagrando os sintomas da SGB (Ref.9). E entre todos os microrganismos que podem engatilhar a SGB, a bactéria Campylobacter jejuni é o mais frequente patógeno associado (26-41% dos casos), geralmente causando gastroenterite várias semanas antes do começo sintomático da síndrome (Ref.3,7).
-----------
(1) A SGB geralmente está associada a alguma doença aguda precedente em cerca de duas a três semanas, envolvendo a geração de resposta celular e humoral por células-T e -B (Ref.10). Como mencionado, o agente infeccioso comumente associado ao desenvolvimento de SGB é o Campylobacter jejuni (cerca de 30% dos casos) seguido do citomegalovírus em 10% dos casos. Outros agentes infecciosos também associados à SGB que podem ser citados são o vírus Epstein Barr, ZIKA vírus, dengue, chikungunya, e [controverso] o vírus da COVID-19 (SARS-CoV-2) (Ref.11-13).
--------------
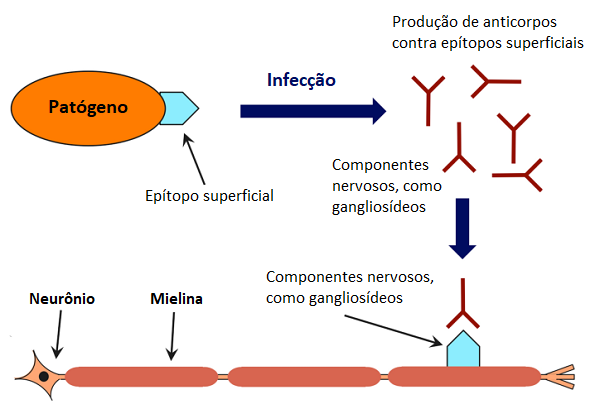
A SGB devido a infecção por C. jejuni é geralmente mais severa do que casos envolvendo outros agentes de gatilho (Ref.7). Robusta evidência sugere que mimetismo molecular existe entre nervos e antígenos microbianos, levando ao desenvolvimento da síndrome relacionada ao C. jejuni (Ref.7, 9, 14). Em especial, os anticorpos do corpo parecem confundir lipo-oligossacarídeos da parede celular de certos subtipos de C. jejuni com gangliosídeos nos nervos periféricos, resultando eventualmente em degeneração de fibras motoras e sensoriais desses nervos (Fig.3). Aliás, o C. jejuni está associado com surtos de SGB ao redor do mundo. Por exemplo, o subtipo ST-2993 engatilhou um surto de SGB em 2007 na província de Jilin, na China, e, em 2019, um grande surto no Peru (Ref.15).
No Peru, casos de GBS não são raros, com um reporte hospitalar anual de 300 a 500 casos, e com taxas crescentes sendo reportadas desde 2015 (Ref.17). No período de maio a julho de 2019, foram identificados quase 690 casos suspeitos ou confirmados de SGB no país (86% afetando pessoas com mais de 30 anos de idade), com um aumento anormal de casos iniciado na Costa Norte do Peru (Ref.18). Nesse notável surto, os principais sintomas clínicos reportados foram dor nas extremidades; fraqueza simétrica, progressiva e ascendente até alcançar o ponto de incapacidade de andar ou segurar algo com as mãos; e, em alguns casos, paralisia muscular (sintomas clássicos da síndrome). Dano axonal foi mais frequente do que envolvimento desmielinizante - também compatível com o C. jejuni sendo o agente de gatilho no surto de 2019 (Ref.19). Taxa de mortalidade foi de 4,3% e taxa de sequelas nos sobreviventes foi superior a 32% (Ref.19).
Aliás, recentemente, o governo Peruano decretou uma nova emergência de saúde pública envolvendo SGB (Ref.20). Quatro mortes já foram confirmadas em 180 casos reportados entre janeiro e julho, e a emergência decretada abrange 25 regiões do país (!).
-----------
(!) É importante realçar que casos de SGB são causados, como regra geral, por agentes infecciosos. Existem muitas desinformações nas redes sociais associando o atual surto no Peru com as vacinas da COVID-19 - e ignorando o surto de 2019. Casos de SGB associados com vacinas são raríssimos e até hoje discutíveis. No mesmo caminho, alguns poucos casos de SGB têm sido associados com vacinas contra a COVID-19 mas com base em evidência observacional (análises retrospectivas), sem estabelecimento de relação causal (Ref.22-27). Aliás, não existe homologia conhecida entre os epítopos na superfície do SARS-CoV-2 e o tecido dos nervos periféricos, contrariando a principal proposta teórica (mimetismo molecular) hoje defendida para explicar a síndrome (Ref.26-27). Em outras palavras, não existe ainda uma explicação biológica plausível para uma relevante relação causal entre SGB e o vírus da COVID-19 - e muito menos relacionando as vacinas, estas as quais são baseadas na estrutura viral desse vírus. Por fim, se as vacinas da COVID-19 causassem um significativo aumento nos casos de SGB, veríamos surtos da síndrome em várias partes do mundo e pouco tempo [2-4 semanas] após as primeiras aplicações vacinais. No geral, não existe sólida evidência de que a taxa de incidência da SGB - a qual já é rara por si só - é aumentada por vacinação de qualquer tipo (Ref.26-27).
> Existe também evidência sugestiva de que fatores genéticos estão associados com suscetibilidade e severidade da SGB (Ref.28). Indivíduos com mais de 50 anos são mais vulneráreis ao desenvolvimento da síndrome (Ref.27).
-------------
Aqui no Brasil, em 2015, tivemos também um surto de SGB em Pernambuco, mas associado com o Zika vírus e afetando em especial a Região Metropolitana do Recife. Nesse período, houve três vezes mais internações por SGB na região do que em 2014; em 44 casos confirmados ou prováveis de SGB, 18 apresentaram sintomas de infecção por Zika até 35 dias antes da ocorrência da SGB, principalmente exantema; houve um caso confirmado laboratorialmente para Zika e um óbito (Ref.15). Aliás, antes da epidemia por Zika vírus na América do Sul, a incidência de SGB para cada 100 mil habitantes era de 0,4 no Brasil, pulando para até 5,6 após a epidemia (Ref.14).
O diagnóstico laboratorial é feito através da análise do líquor cefalorraquidiano, cuja característica clássica é a apresentação da elevação dos níveis de proteínas (>55mg/dl) somado a presença de pouca células mononucleares, resultados encontrados em até 80% dos pacientes após a segunda semana do início do quadro, podendo resultar em valores normais antes de duas semanas, em até 1/3 dos casos.
O tratamento de escolha é realizado por meio da administração de imunoglobulina humana (IgIV) durante 2 a 5 dias e plasmaférese quando necessário. Na verdade, até o momento, imunoglobulina e troca de plasma são os únicos fármacos imune-terapêuticos reconhecidos que podem acelerar a recuperação do paciente afetado pela SGB. Apesar de um prognóstico geralmente favorável, a síndrome ainda é uma doença séria. Mesmo quando tratada com imunoterapias, aproximadamente 5% das pessoas afetadas morrem, e até 20% não conseguem andar de forma independente passado 1 ano da manifestação da síndrome (Ref.14).
REFERÊNCIAS
- https://phil.cdc.gov/Details.aspx?pid=5778
- Kopyta I, Wardak S. [Campylobacter jejuni infection in patient with Guillain-Barré syndrome: a case report]. Medycyna Doswiadczalna i Mikrobiologia. 2008 ;60(1):59-63. PMID: 18634345.
- Quino et al. (2023). Emergence and Molecular Epidemiology of Campylobacter jejuni ST-2993 Associated with a Large Outbreak of Guillain-Barré Syndrome in Peru. Microbiology Spectrum, Vol. 10, No. 5. https://doi.org/10.1128/spectrum.01187-22
- Wen et al. (2023). Guillain–Barre syndrome after myocardial infarction: a case report and literature review. BMC Cardiovascular Disorders 23, 226. https://doi.org/10.1186/s12872-023-03261-4
- Kutsuna et al. (2023). Fulminant Guillain–Barré syndrome secondary to Campylobacter coli infection: An autopsy case report. eNeurologicalSci, Volume 31, 100454. https://doi.org/10.1016/j.ensci.2023.100454
- Willison et al. (2016). Guillain-Barré syndrome. The Lancet, Volume 388, Issue 10045, P717-727. https://doi.org/10.1016/S0140-6736(16)00339-1
- Finsterer, J. (2022). Triggers of Guillain–Barré Syndrome: Campylobacter jejuni Predominates. International Journal of Molecular Sciences, 23(22), 14222. https://doi.org/10.3390/ijms232214222
- Komlakh et al. (2022). Acute Onset of Guillain-Barré Syndrome after Multiple Spine Surgeries: A Rare Case Report. Advanced Biomedical Research, 11:113. https://doi.org/10.4103%2Fabr.abr_311_21
- Laman et al. (2022). Guillain-Barré syndrome: expanding the concept of molecular mimicry. Trends in Immunology, Volume 43, Issue 4, P296-308. https://doi.org/10.1016/j.it.2022.02.003
- https://www.frontiersin.org/articles/10.3389/fneur.2023.1153690/full
- Aladawi et al. (2022). Guillain Barre Syndrome as a Complication of COVID-19: A Systematic Review. Canadian Journal of Neurological Sciences, 49(1), 38-48. https://doi.org/10.1017/cjn.2021.102
- https://periodicos.univag.com.br/index.php/cremed/article/viewFile/1516/1710
- Ahsan et al. (2023). A Case of pediatric Guillain-Barre Syndrome after Respiratory Syncytial Virus Infection. Pediatric Neurology. https://doi.org/10.1016/j.pediatrneurol.2023.06.013
- Shahrizaila et al. (2021). Guillain-Barré syndrome. The Lancet, 397(10280), 1214–1228. https://doi.org/10.1016/S0140-6736(21)00517-1
- Ramos et al. (2021). Guillain-Barré Syndrome Outbreak in Peru 2019 Associated With Campylobacter jejuni Infection. Neurology, Neuroimmunology & Neuroinflammation, 8 (2) e952. https://doi.org/10.1212/NXI.0000000000000952
- Koike et al. (2021). Emerging Infection, Vaccination, and Guillain–Barré Syndrome: A Review. Neurology and Therapy 10, 523–537. https://doi.org/10.1007/s40120-021-00261-4
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6369118/
- Reyes-Vega et al. (2023). Clinical features of Guillain–Barré syndrome and factors associated with mortality during the 2019 outbreak in Peru. J Neurol 270, 369–376. https://doi.org/10.1007/s00415-022-11331-4
- Munayco et al. (2020). Large Outbreak of Guillain-Barré Syndrome, Peru, 2019. Emerging Infectious Diseases, 26(11): 2778–2780. https://doi.org/10.3201%2Feid2611.200127
- https://g1.globo.com/mundo/noticia/2023/07/09/peru-declara-emergencia-de-saude-por-surto-de-sindrome-de-guillain-barre.ghtml
- Nóbrega et al. (2018). Surto de síndrome de Guillain-Barré possivelmente relacionado à infecção prévia pelo vírus Zika, Região Metropolitana do Recife, Pernambuco, Brasil, 2015. Epidemiologia e Serviços de Saúde, 27(2). https://doi.org/10.5123/S1679-49742018000200016
- https://www.nature.com/articles/s41598-023-30940-1
- https://academic.oup.com/brain/article/146/2/739/6532037
- https://link.springer.com/article/10.1007/s12026-022-09316-6
- https://eurjmedres.biomedcentral.com/articles/10.1186/s40001-023-01055-0
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10193105/
- https://www.cdc.gov/vaccinesafety/concerns/guillain-barre-syndrome.html
- Rezaei et al. (2021). Genetic basis of Guillain-Barre syndrome. Journal of Neuroimmunology, Volume 358, 577651. https://doi.org/10.1016/j.jneuroim.2021.577651