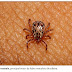
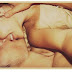
Quais os sintomas da febre maculosa?
Um menino (sexo masculino), 10 anos de idade, morador de área rural no estado do Espírito Santo, foi encaminhado ao serviço de emergência do Hospital Estadual Infantil e Maternidade Alzir Bernardino Alves, em Vila Velha, com um relato de febre há 3 dias, associada a cefaleia (dor de cabeça), mialgia (dor muscular) e dor na panturrilha; o quadro evoluiu com exantema difuso (erupções-manchas cutâneas por todo o corpo), vômitos e diarreia.
História epidemiológica evidenciou moradia próxima a ratos e cavalos. Ao exame físico apresentava-se desidratado, ictérico +/4+, hipocorado +/4+, linfonodomegalia cervical e hepatomegalia, restante do exame sem alterações. O exame laboratorial evidenciou pancitopenia. Foi iniciado tratamento com ceftriaxona e feito expansão volêmica com 20 ml/kg.
Após 14 horas, o paciente evoluiu para um estado de obnubilação, taquipneico, taquicárdico, com sinais de má perfusão periférica, petéquias disseminadas e piora da icterícia. Sem resposta ao tratamento inicial, foi encaminhado à UTI pediátrica (UTIP) com hipotensão, exantema violáceo em membros inferiores e sangramento em locais de punção. Na UTIP, intubação orotraqueal foi realizada, e iniciada administração de adrenalina em infusão contínua, concentrado de plaquetas, vitamina K e associada oxacilina em antibioticoperapia.
Em 24 horas da entrada no hospital, o paciente teve piora do estado geral, com pulsos não palpáveis, múltiplas sufusões hemorrágicas e insuficiência renal. Foram administrados fármacos vasoativos e hemoconcentrados, mas sem resposta. Evoluiu com cinco paradas cardíacas, sendo a última sem sucesso na reanimação. Veio a óbito 12 horas após admissão na UTIP.
O corpo da criança foi encaminhado ao Serviço de Verificação de Óbitos (SVO) para elucidação diagnóstica. Resultado confirmou Febre Maculosa através da reação sorológica de imunofluorescência indireta.
O caso foi descrito e publicado em 2020 no periódico Residência Pediátrica (Ref.1).
FEBRE MACULOSA
O gênero Rickettsia engloba 27 espécies de bactérias intracelulares obrigatórias, e ~17 das quais são consideradas patógenos de animais e humanos. Espécies patogênicas são divididas no grupo da tifo, transmitidos por insetos, e no grupo da febre maculosa, transmitidos por aracnídeos parasitas (em específico, certos ácaros e carrapatos da família Ixodidae). O grupo da tifo inclui dois patógenos: Rickettsia prowazekii, o qual causa tifo epidêmica e é transmitido principalmente pelo contato com fezes infectadas do piolho-humano-de-corpo (Pediculus humanus corporis); e Rickettsia typhi, o qual é responsável pela tifo endêmica ou murina, com a transmissão associada com pulgas.
Sintomas gerais da tifo são não-específicos: dor de cabeça, febre (maior no tifo epidêmico), dor muscular e articular; pacientes também apresentam náusea e vômito, tosse, vermelhidão (moderado na tifo endêmica, mas severa na tifo epidêmica), calafrios, redução na pressão sanguínea, estupor, fotossensibilidade, delírio, e frequentemente morte nos casos não tratados de tifo epidêmica (mortalidade é alta nos casos não-tratados: 10-60%). Mortalidade é reduzida substancialmente com o tratamento antibiótico adequado, administrado dentro dos primeiros dias de infecção.
No grupo da febre maculosa, mais de 25 espécies são englobadas, com pelo menos 15 delas com distribuição global. Sintomas na febre maculosa também não são específicos, e podem variar de espécie para espécie, ficando difícil diferenciar a doença associada de outras infecções com vírus (ex.: dengue) ou bactérias (ex.: leptospirose), ou mesmo de reações medicamentosas (Ref.3). Dependendo da espécie envolvida, pacientes podem apresentar febre alta ou leve, uma escara (crosta) no local de entrada da bactéria, inflamação de nódulos linfáticos regionais ou satélites, vermelhidões eritematosos maculopapulares ou exantema (erupções cutâneas); também pode ocorrer danos a diferentes órgãos devido a vasculite e, em casos extremos, o paciente pode evoluir a óbito.
O patógeno mais letal no grupo da febre maculosa é a espécie Rickettsia rickettsii, representando também a mais importante doença carrapato-associada na América. Aqui no Brasil, a doença causada pelo R. rickettsii (riquétsia) é chamada de Febre Maculosa Brasileira (FMB); nos EUA é conhecida como Febre Maculosa das Montanhas Rochosas (Rocky Mountain spotted fever) e, na Colômbia, como Febre de Tobia (Fiebre de Tobia).
A FMB foi identificada pela primeira vez no Estado de Idaho, nos Estados Unidos, no final do século XIX. Seu nome deveu-se à sua grande incidência nos estados Norte-Americanos cortados pela cadeia das Montanhas Rochosas. Em 1906, o agente etiológico, a R. rickettsii foi descrito pelo Dr. Howard Taylor Ricketts, que identificou também o carrapato como principal vetor de transmissão. Aqui no Brasil, foi reconhecida pela primeira vez em 1929, em São Paulo. Logo depois, foi descrita em Minas Gerais e no Rio de Janeiro. Até o momento, a doença tem sido identificada nos Estados Unidos, Canadá, México, Panamá, Costa Rica, Argentina, Brasil e Colômbia.
A FMB é uma patologia multissistêmica, podendo atingir qualquer órgão ou tecido, e com período de incubação de 2-14 dias (média de 7 dias). Seu início súbito e agudo possui sintomas geralmente inespecíficos – tais como febre alta, mialgia, mal-estar generalizado, náuseas e vômitos –, os quais fazem com que a doença seja confundida com leptospirose, dengue, hepatite viral, salmonelose, encefalite malária e pneumonia causada por Mycoplasma pneumonia.
O sintoma mais importante é o exantema, que aparece geralmente no terceiro-quinto dia da doença, podendo estar ausente em 9-12% dos pacientes, dificultando e retardando ainda mais o diagnóstico. Quando essa dificuldade se une ao desconhecimento por parte da população e à desinformação dos serviços de saúde, o número de mortes pode chegar a 80% dos casos não tratados. Sintomas iniciais comuns incluem febre e problemas gastrointestinais (diarreia, dor abdominal, vômito, náusea) (Ref.6). Em casos raros a infecção pode se manifestar na forma de encefalopatia, incluindo sintomas como confusão mental, dor de cabeça, fala incompreensível, agitação e dificuldade de engolir (Ref.7).
Após o surgimento do exantema, a FMB precisa ser diferenciada do sarampo, meningococcemia estafilococcica, infecções por enterovírus, tifo endêmico, febre tifoide, febre amarela, leptospirose, febre purpúrica brasileira, sepse bacteriana com coagulação intravascular disseminada, lues secundária, rubéola, mononucleose infecciosa, entre outras. No caso de sabida mordida por carrapato, o diagnóstico diferencial deve ainda considerar a doença de Lyme e a erliquiose.
-----------
CASO SUSPEITO DE FMB (Ministério da Saúde): indivíduo que apresente febre de moderada a alta, cefaleia, de início súbito, mialgia, história de picada de carrapatos e/ou contato com animais domésticos e/ou silvestres e/ou tenha frequentado área sabidamente de transmissão da Febre Maculosa, nos últimos 15 dias; ou, ainda, indivíduo que apresente febre de início súbito, mialgia, cefaleia, seguida por aparecimento de exantema maculopapular, entre 2 a 5 dias dos sintomas e/ou manifestações hemorrágicas, excluídas outras patologias.
> A febre maculosa tem sido registrada em São Paulo, Minas Gerais, Rio de Janeiro, Espírito Santo, Bahia, Santa Catarina, Paraná, Rio Grande do Sul, Distrito Federal, Goiás, Ceará, Mato Grosso do Sul, Rondônia e Pernambuco. Santa Catarina e São Paulo são as Unidades Federadas que apresentam os maiores coeficientes de incidência por 100 mil habitantes. Na região Sudeste do Brasil, a taxa de mortalidade se aproxima de 50%.
------------
Uma menor taxa de mortalidade está relacionada ao diagnóstico precoce e à instituição rápida do tratamento apropriado. Caso esse último seja iniciado nos três primeiros dias, essa taxa pode ficar em torno de 2% em crianças e 9% em idosos (acima de 65 anos) (Ref.8). Por isso, todo caso suspeito deve ser imediatamente levado a um atendimento médico.
O diagnóstico laboratorial é feito de duas formas: específico e inespecífico. O primeiro é realizado por meio do isolamento do microrganismo a partir de sangue e tecidos. O segundo detecta anticorpos específicos para R. rickettsii, por intermédio da reação de imunofluorescência indireta (RIFI). A identificação do DNA da Rickettsia também pode ser feita por PCR. Nos últimos anos, o método mais utilizado no diagnóstico é a sorologia, apesar de os anticorpos IgM e IgG aparecerem somente após 7-10 dias do início da doença.
CAPIVARAS, TRANSMISSÃO E FEBRE MACULOSA
A Rickettsia rickettsii circula na natureza por meio dos carrapatos, que desempenham um importante papel não só como vetores, mas também como reservatórios, já que podem transmitir a R. rickettsii à sua progênie de forma vertical, por transmissão transovariana, e também entre os estádios de sua evolução, por transmissão transestadial e interestadial. Dessa forma, o carrapato permanece infectado durante a vida e por muitas gerações após a infecção primária, garantindo o foco endêmico.
A R. rickettsii em animais tem sido detectada em capivaras, gambás, coelhos, equinos, cães e outros animais domésticos e silvestres. É importante destacar o papel destes na cadeia epidemiológica da febre maculosa Brasileira (FMB), pois, além de transportarem os vetores para os domicílios, desempenham papel importante na exacerbação da virulência, alimentando os carrapatos com mais bactérias.
A FMB está normalmente associada às regiões rurais, onde há abundância de animais nos quais o carrapato possa parasitar.
No Brasil, os carrapatos do gênero Amblyomma - espécies A. cajennense, A. aureolatum e A. cooperi ou A. dubitatum -, são seus principais vetores, com destaque para o A. cajennense, conhecido como carrapato-estrela ou rodoleiro, suas ninfas, ou vermelhinhos, e suas larvas, ou "micuins". De qualquer forma, qualquer espécie de carrapato pode ser potencialmente reservatório da R. rickettsii, como o Haemaphysalis leporispalustris (carrapato do coelho) e o Rhipicephalus sanguineus (carrapato do cão).
Os carrapatos se infectam ao se alimentarem em animais infectados, transmitindo o patógeno para os animais susceptíveis, mas o homem tipicamente acaba sendo um hospedeiro acidental.
As alterações causadas pela atuação do homem no habitat natural dos vetores ou dos hospedeiros da FMB geram desequilíbrios (ex.: avanço desenfreado dos ambientes urbanos e desmatamento), alterando significativamente a diversidade das interações e proporcionando um aumento na incidência da doença. Historicamente, a FMB no Brasil tem sido descrita como sendo uma doença de transmissão em áreas rurais, porém nos últimos anos casos têm ocorrido em áreas periurbanas e urbanas, por causa justamente de desequilíbrio ambiental causado por ações antropogênicas. O caso mais notável é a capivara (Hydrochoerus hydrochaeris).
A capivara possui papel importante na epidemiologia da doença em várias regiões Brasileiras. Apesar de não ser capaz de transmitir o agente etiológico da doença - a transmissão é feita exclusivamente pelos carrapatos -, esse grande roedor é um hospedeiro natural com capacidade de ampliar o número de carrapatos infectados, uma vez que mantém altos níveis circulantes de bactérias na corrente sanguínea. De fato, a maioria dos casos de FMB no país está relacionada ao aumento populacional desses mamíferos em áreas compartilhadas por humanos (Ref.9).
A destruição das matas nativas e modificações antrópicas dos espaços naturais aumentam a população de capivaras e mudam seus comportamentos. Esses animais passam a ter alta capacidade reprodutiva, principalmente por terem seus predadores naturais diminuídos, devido ao desmatamento e à ocupação da terra. Além disso, o aumento da produção agrícola permite maior disponibilidade de fonte de alimento para esses mamíferos.
Nesse cenário, e considerando casos confirmados de FMB em regiões com alto número populacional de capivaras circulando em contato próximo com comunidades humanas, orientações técnicas para o manejo desses animais silvestres incluem esterilização e eutanásia, visando reduzir o risco de novos casos da doença. Porém, essas ações preventivas não resolve a raiz do problema, ou seja, devastação ambiental causada por fatores antropogênicos.
Recentemente, uma sessão polêmica na Comissão de Meio Ambiente e Desenvolvimento Sustentável da Câmara, presidida pela Deputada Federal Carla Zambelli (PSL-SP), discutiu o PL 5544/2020 que dispõe sobre a autorização para caça esportiva de animais no território nacional (Ref.10). O PL - de autoria do deputado federal Nilson F. Sainsack (PP-SC) e de relatoria do deputado federal Nelson Barbudo (PSL-MT) - representa mais uma estratégia de suporte para a bandeira pró-armamentista do atual governo federal, e usa como desculpa justamente excessos populacionais de animais como a capivara e a FMB. Durante a Reunião Deliberativa, a presidente Zambelli inclusive usou manchetes de jornal sobre mortes de crianças por FMB no sentido de apoiar o PL.
Esse tipo de "remendo" e oportunismo legislativo, sem debates mais amplos sobre o tema, transforma animais silvestres em "vilões" e apenas desvia o foco da real necessidade: aprimoramento e mais rígida aplicação de políticas públicas de conservação ambiental. Outro fator para reduzir a incidência da doença e o índice de letalidade é o investimento em campanhas de conscientização, incluindo maior esclarecimento para a população sobre sintomas suspeitos e medidas de prevenção. Por fim, o controle sem planejamento apenas dos hospedeiros de maior porte, ignorando os vetores (carrapatos), pode inclusive aumentar as taxas de infecção de humanos em áreas endêmicas, já que os parasitas em grande número ficarão com menos opções de alimento tradicional (animais selvagens) (Ref.11).
MEDIDAS PROFILÁTICAS
A principal medida profilática contra a febre maculosa Brasileira consiste em evitar o contato com o carrapato, mantendo distância de áreas rurais sabidamente endêmicas (Ref.8). Caso haja necessidade de caminhar por essas áreas, devem-se usar roupas brancas que cubram braços e pernas completamente para facilitar a visualização do carrapato. Outra medida importante nesse tipo de área é a utilização de fitas adesivas para vedar a junção entre calças e sapatos. Além disso, deve-se fazer a inspeção do corpo de 3 em 3 horas, pois quanto mais rápido o carrapato for retirado, menores as chances de infecção. Ao encontrar um carrapato aderido à pele, o ideal é retirá-lo com o auxílio de uma pinça, torcendo-o levemente para que se desprenda da pele. Não se deve esmagar o carrapato com as unhas, pois isso levará à exposição das riquétsias, que podem penetrar na pele via microlesões.
A estação seca é o período de maior contaminação e risco de proliferação, com grande número de larvas e ninfas. Nesse período os cuidados devem ser redobrados e é a época ideal para o controle dos carrapatos, exigindo menos quantidade de produto químico, com menos riscos de toxicidade para animais como cavalos, cães e capivaras, e maior eficácia contra os parasitas.
REFERÊNCIAS CIENTÍFICAS
- Wyatt et al. (2020). Febre maculosa: relato de caso. Residência Pediátrica, Volume 10, Número 3. https://doi.org/10.25060/residpediatr
- Bermúdez & Troyo (2018). A review of the genus Rickettsia in Central America. Research and reports in tropical medicine, 9, 103–112. https://doi.org/10.2147/RRTM.S160951
- Jibbe et al. (2021). Rocky Mountain Spotted Fever Misdiagnosed as an Acute Drug Reaction: Diagnostic Clues and Evaluation Recommendations. Kansas journal of medicine, 14, 186–187. https://doi.org/10.17161/kjm.vol1415223
- Fiol et al. (2010). A febre maculosa no Brasil. Revista Panamericana de Salud Pública. https://scielosp.org/article/rpsp/2010.v27n6/461-466/pt/
- Policastro et al. (1997). Rickettsia rickettsii growth and temperatureinducible protein expression in embryonic tick cell lines. Journal of Medical Microbiology - Vol. 46, 839-845.
- Braun et al. (2021). Rocky Mountain Spotted Fever Masquerading as Gastroenteritis: A Common but Overlooked Clinical Presentation. Cureus, 13(4), e14438. https://doi.org/10.7759/cureus.14438
- Isaac et al. (2021). Rocky Mountain Spotted Fever Encephalopathy Open Forum Infectious Diseases, 8 (Suppl. 1):238-239. PMCID: PMC8644059.
- Araújo et al. (2016). Febre maculosa no Brasil: estudo da mortalidade para a vigilância epidemiológica. Cadernos Saúde Coletiva, 24(3). https://doi.org/10.1590/1414-462X201600030094
- Faria et al. (2020). A febre maculosa brasileira e o discurso da mídia impressa: perspectivas de atores envolvidos. Interface - Comunicação, Saúde, Educação; 24. https://doi.org/10.1590/Interface.190784
- https://www.camara.leg.br/evento-legislativo/64529
- https://www.ufmg.br/boletim/bol1858/3.shtml