CRISPR-Cas9: A popularização da edição genética!
- Atualizado no dia 16 de maio de 2025 -
Compartilhe o artigo:
Em 2016, os Chineses foram pioneiros no mundo a tratar um paciente com câncer de pulmão através de células imunológicas modificadas pela técnica CRISPR-Cas9 (Ref.7,11-12). O time responsável pelo procedimento foi liderado pelo Dr. Lu You, um oncologista na Universidade Sichuan, no Hospital do Oeste da China, em Chengdu. Os testes começaram em agosto do mesmo ano, após aprovação ética do hospital. Um paciente com câncer avançado no pulmão - e sem outras opções terapêuticas - recebeu o tratamento.
Os pesquisadores cortaram o gene responsável pela produção da proteína PD-1 em células de defesa retiradas do próprio paciente. Essa proteína age como um freio para as respostas imunológicas, algo aproveitado pelas células cancerígenas para driblar as defesas do organismo. Logo em seguida, os pesquisadores multiplicaram as células editadas e as injetaram no paciente, com a esperança de que elas pudessem atacar agressivamente o tumor. Os resultados obtidos foram promissores e podem espelhar esperança para o tratamento de outros tipos de cânceres, mas muito ainda precisa ser otimizado para garantir a segurança e efetividade do procedimento em um maior espectro de pacientes.
Mas, afinal, o que é o tão famoso e popular Crispr-Cas9? Porque essa ferramenta se tornou o editor genético mais recorrente nas pesquisas científicas? Quais são suas vantagens e suas desvantagens?
- Continua após o anúncio -
CRISPR-Cas9
CRISPR é uma sigla em inglês para Clustered Regularly Interspaced Short Palindromic Repeats (Repetições Curtas Palindrômicas de Grupos Regulares Interespaçados). O Cas9 no nome serve para discriminar proteínas ('9') associadas ('as') ao CRISPR. Em geral, o CRISPR-Cas é um recurso biológico utilizado pelas bactérias para alvejar e inutilizar o DNA de organismos bacteriófagos (que atacam/comem bactérias), como certos tipos de vírus (1), e impedir que esses parasitas cumpram suas funções normais. Em outras palavras, é uma espécie de sistema imunológico de organismos procariontes. O CRISPR-Cas9 é específico do Streptococcus pyogenes e de alguns outros tipos de bactérias. Por causa das peculiaridades do processo, o CRISPR-Cas9 tornou-se uma revolucionária ferramenta de edição genética, e ainda continua sendo o mais popular editor de genes. Aliás, em 2020, cientistas pioneiros no desenvolvimento do CRISPR como editor genético ganharam o Prêmio Nobel de Química (Ref.16).
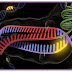
 |
| Estrutura cristalina do CRISP-Cas9, resolvida em 2014; cada região colorida possui um papel específico na enzima. |
(1) Para mais informações:
O CRISPR-Cas9 é uma enzima endonuclease guiada por um fragmento de RNA. A partir de um complexo mecanismo bioquímico de ação, essa enzima se liga a uma parte do DNA alvo, guiada pelo fragmento de RNA, e, como uma tesoura, corta uma sequência desse trecho em um ponto específico. Normalmente, o maquinário reparador do DNA consegue remendar o corte, mas frequentemente comete erros durante o conserto, e é nisso que as bactérias apostam, para que o vírus predador, por exemplo, não atue como deveria. Aproveitando-se desse mecanismo natural de defesa, os cientistas reaproveitaram esse sistema para explorar e alterar sequências genéticas específicas nas mais variadas células. Modificando o CRISPR-Cas9 eles podem programar diferentes fragmentos de RNA para se anexarem em pontos específicos do DNA alvo, sem o cortarem, e impedir a expressão de um gene X (2). A enzima modificada é chamada, nesse caso, de 'CRISPR-Cas9 morto', e é capaz de criar uma espécie de bloqueio, onde o RNA polimerase, por exemplo, não conseguiria alcançar o gene bloqueado e produzir uma proteína prevista pelo código genético.
Criando ativadores, os cientistas podem pegar o CRISPR-Cas9 morto utilizado e fazê-lo expressar o gene bloqueado, mesmo se esse gene não tiver sido programado para ficar ativo no DNA (3). Com isso, é possível criar verdadeiros interruptores genéticos, fazendo com que os genes de interesse sejam ligados e desligados ao bel prazer dos cientistas. Além disso, com a ajuda de guia do CRISPR-Cas9, modificações podem ser feitas em um local específico do DNA e até genes de interesse podem ser anexados caso seja usado o poder de corte do sistema enzimático (corta-se um ponto do DNA para a inserção de um gene Y no lugar).
 |
| Adaptação de uma esquema elaborado pela Nature (Ref.7), mostrando a ação do CRISPR-Cas9 e duas das suas aplicações. |
------------
(1) Um gene é a região do DNA que coordena uma função específica e é unidade molecular da hereditariedade. Ou seja, longas sequências de nucleotídeos, com suas bases nitrogenadas correspondentes (adenina, guanina, citosina e timina, no caso do DNA), correspondem a um gene, o qual pode coordenar a produção de uma proteína específica através de um RNA transcrito. Dentro dos cromossomos, os quais são formados por longas cadeias de DNA, encontramos milhares de genes, os quais formam genoma. Devido à existência de vírus que usam o RNA como código genético, atualmente considera-se que os genes também englobam regiões do RNA. Para mais informações: Cientistas "brincando de Deus": Letras artificiais no DNA
(2) É sabido que apenas ~2% dos genes expressos no código genético de uma pessoa estão realmente ativos, com o restante não possuindo função clara no organismo. Porém, estudos nas últimas décadas vêm apontando que grande parte desse "entulho de genes" possui importante papel regulador. Além disso, certos genes no corpo só são expressos através de mecanismos epigenéticos (ex.: após algum estímulo ambiental). Leitura recomendada: Epigenética, Plasticidade Fenotípica e Evolução Biológica
(2) É sabido que apenas ~2% dos genes expressos no código genético de uma pessoa estão realmente ativos, com o restante não possuindo função clara no organismo. Porém, estudos nas últimas décadas vêm apontando que grande parte desse "entulho de genes" possui importante papel regulador. Além disso, certos genes no corpo só são expressos através de mecanismos epigenéticos (ex.: após algum estímulo ambiental). Leitura recomendada: Epigenética, Plasticidade Fenotípica e Evolução Biológica
-----------
Curioso apontar que um estudo publicado na Molecullar Cell (Ref.14) mostrou que o CRISPR/Cas9 não é usado naturalmente apenas para a defesa contra material genético externo. Bactérias também podem usar o editor para atividades regulatórias, assim como fazem os cientistas, bloqueando a atividade genética no próprio DNA - e sem o mecanismo de clivagem -, com o objetivo de desligar ou ligar genes. No estudo, os pesquisadores analisaram a bactéria patogênica Francisella novicida, mostrando que essa espécie usa o Cas9 para mediar uma interferência transcricional - ligando DNA endógeno com scaRNA e reprimindo a transcrição - para potencializar a virulência bacteriana.
- Continua após o anúncio -
APLICAÇÕES NOTÁVEIS
Em 2015, pesquisadores no laboratório norte-americano do CCR (Centro para Pesquisas do Câncer, na tradução da sigla em inglês), em 2015, programaram o CRISPR-Cas9 para desativarem 9 mil potenciais genes ligados ao crescimento de tumores em ratos e em humanos (Ref.2). Esses genes, listados em uma biblioteca genética, eram desativados para os pesquisadores observarem os efeitos consequentes provocados no crescimento tumoral. Ou seja, cada população de células tumorais, em milhares, tinha um gene específico em seu DNA desativado. As populações de células que se desenvolviam com dificuldade mostravam que um gene X, entre os 9 mil sendo testados, era importante para o crescimento. Se esse gene X não for necessário para células saudáveis crescerem, ele se torna um ótimo alvo para medicamentos que visem desativá-lo de vez no corpo de um paciente com câncer.
Diversos outros exemplos de avanços biotecnológicos e na medicina podem ser citados. O CRISPR-Cas9 hoje protagoniza grande parte dos estudos genéticos - clínicos e teóricos - e diariamente os periódicos científicos publicam trabalhos realizados com o auxílio desse editor genético. Aliás, desde 2018, existe um periódico exclusivamente dedicado a publicar e explorar estudos e avanços relacionados ao CRISPR: The CRISPR Journal.
Mais recentemente, as agências reguladoras no Reino Unido aprovaram uma terapia (Casgevy,) que usa o CRISPR para o tratamento [cura] de duas condições sanguíneas: anemia falciforme (diagnóstico anual de ~300 mil pacientes) e beta talassemia (diagnóstico anual de ~60 mil pacientes) (Ref.17). Ambas são as doenças monogênicas mais comuns ao redor do mundo.
Descrita pela primeira vez em 1904 por James Herrick - e com maior prevalência em populações Africanas -, a doença (ou anemia) falciforme é a doença hematológica hereditária mais comum do mundo. Sua etiologia gênica apresenta um padrão autossômico recessivo devido a uma mutação de ponto (GAG->GTG) no gene da globina beta da hemoglobina (Hb), resultando no aparecimento de uma hemoglobina anormal, denominada hemoglobina S (Hb S). Essa mutação leva à substituição do ácido glutâmico pela valina na posição 6 da cadeia beta e, como consequência, à modificação físico-química de toda a molécula da hemoglobina.3 O ácido glutâmico é carregado negativamente enquanto a valina é um aminoácido neutro, resultando numa alteração de carga da molécula de Hb, o que resulta em uma mobilidade mais lenta da Hb S quando comparada com a Hb A em análise eletroforética.4
Decorrentes de suas características físicas, sob determinadas situações, a Hb S pode se polimerizar, causando a deformação das hemácias, que assumem forma de foice e que são responsáveis por vaso-oclusão, episódios de dor e lesões de órgãos. Indivíduos heterozigotos da Hb S são assintomáticos e representados laboratorialmente por Hb AS. Esses indivíduos não apresentam a doença, nem possuem anormalidades no número e forma das hemácias, geralmente evidenciadas por análise de rotina.4 Entretanto, há relatos de morte súbita e complicações clínicas, tais como: hematúria, hipostenúria, embolismo pulmonar e infarto esplênico especialmente quando os portadores são expostos a condições extremas de baixa tensão de oxigênio (O2), como ocorre em esforços físicos extenuantes e despressurização da cabine de vôo.
A talassemia é um grupo de defeitos sanguíneos hereditários e está entre as hemoglobinopatias mais prevalentes do mundo. As talassemias são de dois tipos, como talassemia alfa e beta. As causas desses defeitos são as mutações genéticas que levam a níveis baixos e/ou proteínas de globina com mau funcionamento, respectivamente. Em alguns casos, uma dessas proteínas pode estar completamente ausente. As cadeias de globina α e β formam uma dobra ou bolsa de globina para a fixação de heme (Fe ++) para transportar oxigênio. Os genes das proteínas alfa e beta globina estão presentes na forma de um cluster nos cromossomos 16 e 11, respectivamente.
Diferentes genes de globina são usados em diferentes estágios do curso de vida. Durante os estágios de desenvolvimento embrionário e fetal, as proteínas γ globina se associam à α globina e, posteriormente, são substituídas pela proteína β globina. Os desequilíbrios da cadeia de globina resultam em hemólise e impedem a eritropoiese. Indivíduos que apresentam sintomas leves incluem portadores de talassemia alfa ou as pessoas com traços de talassemia alfa ou beta. A talassemia alfa causa condições como anemia hemolítica ou hidropsia fetal fatal, dependendo da gravidade da doença. A beta talassemia principal resulta em anemia hemolítica, retardo de crescimento e aberrações esqueléticas na primeira infância. As crianças afetadas por esse distúrbio precisam de transfusões de sangue regulares ao longo da vida. Os pacientes que dependem de transfusão de sangue geralmente desenvolvem sobrecarga de ferro que causa outras complicações nos sistemas do corpo, como insuficiência renal ou hepática.
A única cura para as talassemias seria um transplante de medula óssea - sem atualmente uma taxa de sucesso significativa - ou terapia genética. Estudos nos últimos anos vêm mostrando que o uso de CRISPR-Cas9 é uma intervenção efetiva e promissora para tratar a beta-talassemia e também a anemia falciforme (Ref.18-20).
Na nova decisão no Reino Unido, a terapia chamada de Casgevy, desenvolvida pela Vertex Pharmaceuticals, em Boston, Massachusetts, e pela CRISPR Therapeutics, em Zug, Suíça, foi aprovada com base em resultados de dois testes clínicos com suficiente tempo de acompanhamento (Ref.17).
No teste clínico para a anemia falciforme, 29 de 45 participantes foram acompanhados por tempo suficiente para resultados interinos. O Casgevy completamente aliviou 28 desses pacientes de episódios debilitantes de dor por pelo menos um ano pós-tratamento.
Em outro teste clínico, pesquisadores testaram a terapia para uma forma severa de beta-talassemia, a qual é tradicionalmente tratada com transfusões sanguíneas quase mensais. Do total de participantes (n = 54) que receberam Casgevy, 42 pacientes participaram por tempo suficiente para resultados interinos. Por pelo menos 1 ano pós-tratamento, 39 participantes (93%) não mais precisaram de transfusão sanguínea; os outros três participantes reduziram a necessidade de transfusão sanguínea em mais de 70%.
No tratamento com Casgevy, células-tronco produtoras de células sanguíneas são extraídas da medula óssea do paciente com beta-talassemia ou com anemia falciforme. Essas células são modificadas com o editor genético CRISPR, usando a enzima Cas9 para editar um gene associado com produção de hemoglobina. No caso, um gene chamado de BCL11A é cortado nas duas fitas do DNA - esse gene geralmente previne a produção de uma forma de hemoglobina que é feita apenas em fetos; com esse gene disfuncional, hemoglobinas fetais passam a ser produzidas e que não carregam as mesmas anormalidades que as hemoglobinas adultas de indivíduos com anemia falciforme ou beta-talassemia. Antes das células editadas serem injetadas de volta nos pacientes, esses últimos precisam ser submetidos a um tratamento que prepara a medula óssea para recebê-las (quimioterapia para limpar o corpo das células doentes). Após a injeção das células editadas, o corpo passa a produzir hemoglobinas fetais.
Algum tempo depois da injeção, pacientes já começam a experienciar alívio de sintomas devido ao aumento do suprimento de oxigênio no corpo. Pacientes ainda podem precisar passar mais pelo menos 1 mês no hospital para acompanhamento e suporte durante a crescente produção de hemoglobinas saudáveis no sangue.
Nenhum risco de sério efeito adverso foi observado nos pacientes tratados. Efeitos colaterais comuns incluem náusea, fatiga, febre e um risco aumentado de infecção. Os pacientes tratados ainda continuam sendo monitorados para potenciais novos efeitos adversos, e um estudo clínico mais recente no periódico NEJM (Ref.19) reforçou a eficácia da técnica em novos pacientes. O maior temor ainda continua edição incorreta de genes, mas nenhum problema do tipo foi ainda reportado. Aliás, a Administração de Drogas e Alimentos dos EUA (FDA) é esperada também de aprovar em breve o Casgevy (cujo nome genérico é exa-cel) (Ref.21) (!).
------------
(!) ATUALIZAÇÃO: O FDA aprovou em 2023 o uso do Casgevy. A aprovação abre também caminho para a aplicação terapêutica de editores genéticos mais eficazes baseados no CRISPR. Ref.
------------
Custo do tratamento, porém, será um fator muito limitante. Estimativas sugerem US$2 milhões por paciente no Reino Unido, em concordância com o preço de outras terapias genéticas. Como em toda nova tecnologia, é esperado que os preços caiam dramaticamente nos próximos anos.
> Usando terapia genética* para o mesmo fim (desativação do gene BCL11A), pesquisadores também reportaram recentemente sucesso no tratamento de anemia falciforme em 6 pacientes (Ref.22).
* Leitura recomendada: Como funciona a Terapia Genética?
> Um recente e controverso estudo clínico trouxe resultados promissores relativos ao uso do CRISPR para o controle de colesterol no corpo. O tratamento em questão (VERVE-101) desativa de forma permanente um gene no fígado chamado PCSK9. Esse gene [enzima codificada] controla o nível de lipoproteína de baixa densidade (LDL) no sangue - um transportador de colesterol apelidado de "mau colesterol" e que está envolvido no desenvolvimento de doenças cardíacas quando em excesso. Com apenas uma injeção do VERVE-101, voluntários exibiram uma redução de até 55% na quantidade de LDL circulante. Porém, o estudo foi também alvo de bastante criticismo por causa de dois sérios eventos adversos reportados, incluindo uma morte. Isso em especial porque existem tratamentos tradicionais eficazes para o controle de colesterol, com especialistas argumentando que terapias genéticas deveriam priorizar condições sem tratamento disponível ou efetivo. Ref.23
- Continua após o anúncio -
LIMITAÇÕES E AVANÇOS
Nesse ponto, é bom deixar bem claro que o CRISPR-Cas9 não é a única ferramenta de edição genética e, de longe, também não é a melhor. Técnicas como a ´Zinc-finger Nucleases´ e a ´Transcription Activator-like Effector Nucleases (TALENs)´ são muito mais eficientes e produzem bem menos erros de edição genética. A fama e popularidade do CRISPR-Cas9 reside no seu baixo custo, rapidez e facilidade de operação em relação às outras técnicas. Qualquer laboratório com um porte mínimo consegue usar o processo com tranquilidade e boa eficácia, permitindo a realização de vários experimentos em um curto espaço de tempo e a custos acessíveis. Contudo, é preciso ficar de olho também nas deficiências do CRISPR-Cas9, sendo necessário checar sempre os resultados de experimentos com muito cuidado. Nos procedimentos de desativação do PD-1, por exemplo, os pesquisadores precisam ter certeza se o gene visado foi realmente desativado e não outra parte do código genético dentro das células-T, algo que poderia ser desastroso.
Nesse contexto, é fácil entender também o porquê de existir uma certa polêmica em cima do uso do CRISPR-Cas9. Já que é um método fácil de ser usado e barato, fica difícil controlar quem está usando a ferramenta ao redor do mundo. Pesquisas genéticas ilegais podem estar sendo feitas e a ética científica quebrada em vários cantos. Editar genes é perigoso se feito de qualquer jeito, porque isso pode criar mutações e produtos biológicos diversos e perigosos para o meio ambiente, caso o material genético modificado vaze dos laboratórios. Dentro da China, por exemplo, onde pesquisas do tipo são amplamente liberadas e conduzidas, e com poucas restrições, isso se torna extremamente preocupante.
Mas avanços para contornar esses problemas e tornar o popular editor genético mais preciso e seguro estão constantemente sendo reportados.
No começo de 2018, cientistas da Escola de Medicina da Universidade de Massachusetts, EUA, conseguiram otimizar substancialmente o CRISPR-Cas9 (Ref.13). A enzima que guia o CRISPR (SpCas9) - oriunda de uma fonte natural , no caso a já mencionada bactéria S. pyogenes - pode apenas interagir efetivamente com segmentos no genoma que possuem um final ou um trio específico de bases: N, onde N é qualquer uma das quatro bases do DNA, seguido por duas guaninas (G) - NGG. Somente cerca de um sexto das 3,2 bilhões de bases no genoma humano, por exemplo, possuem a sequência certa, o que gera uma gigantesca limitação.
Nesse sentido, os pesquisadores conseguiram criar uma versão modificada do Cas9 que é, no mínimo, quatro vezes mais abrangente - em termos de interatividade - do que a enzima original. Inúmeros novos genes podem ser agora modificados no DNA humano, algo antes impossível com o CRISPR tradicional. A nova enzima - xCas9 - consegue interagir com a sequência NGN - encontrada em cerca de um quarto do genoma - e outras que incluem a NG, GAA e GAT. Além disso, o xCas9 mostra uma alta especificidade pelo gene alvo, diminuindo bastante as mutações indesejadas.
No final de 2019, pesquisadores anunciaram inclusive uma alternativa ao Cas9, acessível e muito mais eficiente do que quaisquer outros editores. O novo editor genético desenvolvido - e reportado na Nature (4) - une o CRISPR com um Cas9 modificado fusionado com uma enzima transcriptase reversa (usada por retrovírus para introduzir seu material genético no DNA da célula hospedeira). O sistema, chamado de prime editing, é capaz de direcionar a edição em células humanas de forma precisa, eficiente e altamente versátil, e ainda possui o potencial de corrigir acima de 89% das mais de 75 mil doenças associadas com variantes genéticas listadas na ClinVar, um banco de dados públicos construído pelos Institutos Nacionais de Saúde dos EUA.
(4) Para mais informações:
E talvez ainda mais impressionante, em um estudo publicado em 2020 na Science (Ref.15) pesquisadores reportaram o desenvolvimento de um RNA-guia quimicamente aprisionado que permite o Cas9 se ligar ao DNA mas sem clivá-lo até a ativação por luz (somente quando exposto a fótons de um comprimento de onda particular). Essa estratégia, chamada de 'CRISPR muito rápido' (vfCRISPR), cria clivagens na cadeia dupla do DNA a escalas submicrométricas e de segundos, e possibilita a edição de alelos únicos. Edições de genes com tecnologias anteriores demoravam horas e alteravam alelos alvos em ambas as cadeias de DNA (ambas as cópias de um gene), além de impossibilitarem o estudo mais detalhado dos mecanismos de reparação do DNA.
Outros CRISPR-Cas de bactérias diversas têm sido também analisados para o desenvolvimento de outras potenciais ferramentas de edição genética.
Outros CRISPR-Cas de bactérias diversas têm sido também analisados para o desenvolvimento de outras potenciais ferramentas de edição genética.
> Usando uma "super" variação do CRISPR, chamada de Prime Editing, pesquisadores conseguiram melhorar o quadro de um adolescente sofrendo com doença granulomatosa crônica, uma desordem imunológica rara e hereditária. Ref.25
Edição de Genes Inteiros
Um novo sistema CRISPR foi recentemente desenvolvido por cientistas da Universidade de Columbia, EUA, e usa uma enzima transposase otimizada para "colar" genes inteiros no genoma alvo (Ref.26-27).
Transposases são enzimas que permitem o movimento dos chamados "genes saltitantes" (jumping genes) - sequências de DNA que se movimentam ao longo do genoma, propagando a si mesmas no processo. Sistemas baseados na associação da enzima transposase com o CRISPR (CASTs) ocorrem naturalmente em bactérias, mas não são eficientes em editar o genoma em células humanas (eficiência tipicamente inferior a 0,1%).
No novo avanço, os pesquisadores otimizaram um sistema CAST através de evolução direta (envolvendo uso de bacteriófagos) -, criando o que eles chamaram de evoCAST, capaz de inserir longas sequências (>10 mil nucleotídeos) com uma eficiência de até 30% ao longo de múltiplos locais genômicos de células humanas - requerendo apenas um único passo enzimático e sem criar quebras de cadeia-dupla no genoma. Essas sequências eram longas o suficiente para entregar genes inteiros e seus elementos de controle.
 |
| CASTs exploram um sistema CRISPR-Cas nuclease-deficiente para recrutar um complexo transposase que catalisa integração de sequências longas de DNA no genoma. |
> O procedimento de evolução direta usado - sob contínua seleção ao longo de centenas de gerações - foi planejado para garantir sobrevivência dos bacteriófagos (vírus que infectam bactérias) com a melhor forma da enzima transposase no sentido de editar genoma humano. É a teoria evolutiva sendo usada na prática laboratorial para avanços na medicina.
REFERÊNCIAS CIENTÍFICAS
- http://www.nature.com/news/chinese-scientists-to-pioneer-first-human-crispr-trial-1.20302
- http://www.cancer.gov/about-cancer/causes-prevention/research/crispr
- http://www.nature.com/news/chinese-scientists-genetically-modify-human-embryos-1.17378
- http://www.nature.com/news/crispr-the-disruptor-1.17673
- http://www.ncbi.nlm.nih.gov/pubmed/27120160
- http://www.ncbi.nlm.nih.gov/pubmed/25827103
- http://www.nature.com/news/crispr-gene-editing-is-just-the-beginning-1.19510
- http://www.ncbi.nlm.nih.gov/pubmed/25408407
- https://www.ncbi.nlm.nih.gov/pubmed/26562159
- http://www.seminoncol.org/article/S0093-7754(10)00159-4/abstract
- http://www.nature.com/news/crispr-gene-editing-tested-in-a-person-for-the-first-time-1.20988
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6315587/
- https://www.nature.com/articles/nature26155
- https://www.sciencedirect.com/science/article/abs/pii/S1097276519304010
- https://science.sciencemag.org/content/368/6496/1265
- https://www.nature.com/articles/d41586-020-02765-9
- https://www.nature.com/articles/d41586-023-03590-6
- https://www.nejm.org/doi/full/10.1056/NEJMoa2215643
- https://www.nejm.org/doi/full/10.1056/NEJMoa2031054
- https://www.sciencedirect.com/science/article/abs/pii/S0378111923003219
- https://www.science.org/content/article/crispr-and-another-genetic-strategy-fix-cell-defects-two-common-blood-disorders
- https://www.nejm.org/doi/full/10.1056/NEJMoa2029392
- https://www.nature.com/articles/d41586-023-03543-z
- https://www.nature.com/articles/d41586-023-03797-7
- Heath et al. (2023). Prime Editing Efficiently and Precisely Corrects Causative Mutation in Chronic Granulomatous Disease, Restoring Myeloid Function: Toward Development of a Prime Edited Autologous Hematopoietic Stem Cell Therapy. Blood, 142 (Supplement 1): 7129. https://doi.org/10.1182/blood-2023-186365
- Witte et al. (2025). Programmable gene insertion in human cells with a laboratory-evolved CRISPR-associated transposase. Science, Vol. 388, No. 6748. https://doi.org/10.1126/science.adt5199
- https://www.nature.com/articles/d41586-025-01518-w